CIENCIA3: COMBINACIONES. Los coeficientes binomiales o combinaciones son una serie de números estudiados en combinatoria que indican el número de formas en que se pueden extraer subconjuntos a partir de un conjunto dado. Sin embargo, dependiendo del enfoque que tenga la exposición, se suelen usar otras definiciones equivalentes.
Coeficiente binomial
Los coeficientes binomiales o combinaciones son una serie de números estudiados en combinatoria que indican el número de formas en que se pueden extraer subconjuntos a partir de un conjunto dado. Sin embargo, dependiendo del enfoque que tenga la exposición, se suelen usar otras definiciones equivalentes.
Contenido[ocultar] |
[editar] Definición combinatoria
Se tiene un conjunto con 6 objetos diferentes {A,B,C,D,E,F}, de los cuales se desea escoger 2 (sin importar el orden de elección). Existen 15 formas de efectuar tal elección:
| A,B | A,C | A,D | A,E | A,F |
| B,C | B,D | B,E | B,F | |
| C,D | C,E | C,F | ||
| D,E | D,F | |||
| E,F |
El número de formas de escoger k elementos a partir de un conjunto de n, puede denotarse de varias formas:[1] 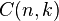 ,
, 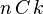 ,
, 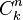 , o
, o 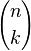 . Así, en el ejemplo anterior se tiene entonces que C(6,2)=15, puesto que hay 15 formas de escoger 2 objetos a partir de un conjunto con 6 elementos.
. Así, en el ejemplo anterior se tiene entonces que C(6,2)=15, puesto que hay 15 formas de escoger 2 objetos a partir de un conjunto con 6 elementos.
Los números C(n,k) se conocen como «coeficientes binomiales», pero es frecuente referirse a ellos como «combinaciones de n en k», o simplemente «n en k». Por tanto, la primera definición es:
|
Es importante notar que la definición asume implícitamente que n y k son enteros, que no son negativos, y además k no excede a n. Podemos definir C(n,k)=0 si k>n, puesto que no es posible escoger más elementos que los que tiene el conjunto dado (por tanto hay cero formas de hacer la elección). Estas precisiones cobrarán relevancia más adelante cuando se discutan generalizaciones del concepto (por ejemplo, cuando n o k sean negativos o cuando no sean números enteros).
[editar] Definición algebraica
La definición no permite calcular el valor de los coeficientes binomiales, salvo listando los subconjuntosy contándolos. Sin embargo, existe una fórmulaexplícita que nos proporciona el valor de C(n,k).
Supongamos que el conjunto original tiene 5 elementos, de los cuales se deben escoger 3. Al momento de escoger el primero, se tiene 5 opciones disponibles, pero una vez fijo el primero, sólo hay 4 opciones para el segundo, y por tanto sólo 3 opciones para el último (pues no se puede repetir los escogidos en los primeros 2 pasos). De este modo, la selección puede hacerse de 5×4×3=60 formas.
Sin embargo, en tal conteo, el orden en que se escogen los elementos hace diferencia. Por ejemplo, tomar C, luego B, luego E, es una selección diferente de tomar B, luego C y luego E. Pero en la definición de coeficiente binomial, no importa el orden en que se eligen los objetos, únicamente cuáles se escogen. Por tanto, las elecciones BCE, BEC, CEB, CBE, ECB y EBC son todas equivalentes. Del mismo modo, las elecciones ABC, ACB, BCA, BAC, CAB y CBA son equivalentes, y así para cualquier terna de letras.
De esta forma, el resultado obtenido (60) no es la cantidad de subconjuntos de 3 elementos de {A,B,C,D,E}, sino que cada subconjunto está contado 6 veces, por lo que la cantidad de subconjuntos es realmente 60/6 = 10.
El argumento presentado para el ejemplo puede generalizarse de la siguiente forma. Si se tiene un conjunto con n elementos, de los cuales se van a escoger k de ellos, la elección (ordenada) puede hacerse de
n × (n-1) × (n-2) ×... × (n-k+1)ya que en el primer paso se tienen n opciones, en el segundo se tienen n-1, en el tercero n-2, y así sucesivamente, terminando en el paso k que tendrá n-k+1 opciones.
Ahora, hay que dividir el producto anterior entre el número de selecciones «equivalentes». Pero si se tiene k objetos, hay k! formas de permutarlos, es decir, k! formas de listarlos en distinto orden. Recordemos que k! se lee k-factorial y es igual a
k! = 1×2×3×...× kConcluimos que el número de subconjuntos con k elementos, escogidos de un conjunto con n elementos es
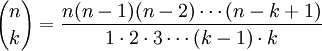 .
.Multiplicando el numerador y el denominador de la fracción por 1×2×3×···×(n-k)
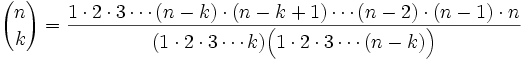
La expresión anterior puede escribirse de forma más compacta usando factoriales, expresión que es usada en ocasiones como la definición misma de coeficiente binomial (sobre todo en textos elementales que no explican el origen combinatorio de la misma):
|
[editar] El teorema de Newton y coeficientes multinomiales
Finalmente, existe una tercera forma de definir los coeficientes binomiales, la cual da origen a su nombre. Sin embargo, esta definición obscurece el significado combinatorio de los números, pues la equivalencia con las definiciones anteriores no es evidente.
|
Por ejemplo, si desarrollamos (x+y)5 obtenemos:
(x + y)5 = x5 + 5x4y + 10x3y2 + 10x2y3 + 5xy4 + y5,por tanto, al ser 10 el coeficiente de x³y², concluimos que C(5,3)=10.
La afirmación de que esta definición es equivalente a las anteriores se conoce como teorema binomial o teorema de Newton, quien dio una prueba de una versión general del resultado. Sin embargo, la forma de calcular los coeficientes era conocida por diversas culturas con muchos siglos de anticipación.
Para ilustrar la equivalencia entre esta definición y la anterior, consideremos un ejemplo con n=3, k=2. Podemos pensar que los factores de (x+y)³=(x+y)(x+y)(x+y) están coloreados de azul, rojo y verde respectivamente.
Por un lado, se sabe que (x+y)³ = x³+3x²y+3xy²+y³, por lo que el coeficiente de x²y es 3. Por otro lado, al desarrollar los factores, aparecerá un término x²y cada vez que se elija dos colores para x (dejando el color restante para y). El número de formas de escoger 2 colores entre 3 posibles opciones es precisamente C(3,2), como se estableció con anterioridad. La conclusión es que el coeficiente de x²y es necesariamente C(3,2).
Para el caso general, se puede imaginar que los n factores de (x+y)n han sido coloreados con diferentes colores, por lo que el coeficiente de xkyn-k será igual al número de formas de escoger k colores para asignarlos a la variable x (dejando los n-k colores restantes para y). El número de formas para escoger k colores entre n posibles opciones es C(n,k), con lo que se termina la prueba.
En contextos más técnicos, suele usarse una forma diferente de expresar el teorema de Newton mediante el uso de sumatorios:
|
Esta fórmula se generaliza para más de dos sumandos de la siguiente manera:
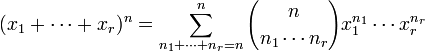 ,
,donde 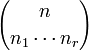 es un coeficiente multinomial que se define:
es un coeficiente multinomial que se define: 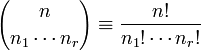 . Los coeficientes multinomiales también tienen definición combinatoria. Puesto que n no es más que la suma de n1, n2,... y nr, también se emplean notaciones en las que n, no aparece, como
. Los coeficientes multinomiales también tienen definición combinatoria. Puesto que n no es más que la suma de n1, n2,... y nr, también se emplean notaciones en las que n, no aparece, como 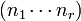 . Otras notaciones son
. Otras notaciones son 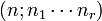 ó
ó 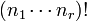 .
.
[editar] El teorema de Pascal
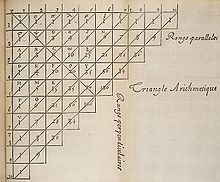
En 1654, Blaise Pascal entabló correspondencia con Pierre de Fermat sobre ciertos problemas de probabilidad, correspondencia que daría origen a su Traité du triangle arithmétique, considerado uno de los trabajos pioneros en el estudio moderno de la probabilidad. En ese trabajo, entre otras cosas, estudia lo que hoy se conoce como triángulo de Pascal que es un arreglo de números definido a continuación.
Se tiene una cuadrícula rectangular en la cual se escribe el número 1 en las casillas del borde superior y el borde derecho:
| 1 | 1 | 1 | 1 | ... |
| 1 | ||||
| 1 | ||||
| 1 | ||||
| ... |
Los números de las demás casillas se obtienen con la siguiente regla: en cada casilla se escribe la suma de los valores de las dos casillas contiguas situadas a su izquierda y en la parte superior:
| 1 | 1 | 1 | 1 | 1 | 1 | 1 | ... |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ... |
| 1 | 3 | 6 | 10 | 15 | 21 | 28 | ... |
| 1 | 4 | 10 | 20 | 35 | 56 | 84 | ... |
| ... | ... | ... | ... | ... | ... | ... |
Es común, sin embargo, presentar el arreglo en forma triangular, con los bordes inclinados, tal como se ilustra en la figura. De esta forma, cada número es igual a la suma de los dos que se encuentran arriba del mismo.
Pascal notó que para cualquier entero n, se cumple que
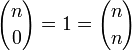
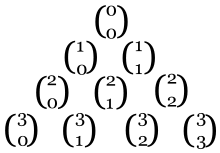
ya que sólo hay una forma de escoger cero o todos los elementos de un conjunto dado. De esta forma, se pueden reescribir los bordes como:
| C(0,0) | C(1,1) | C(2,2) | C(3,3) | ... |
| C(1,0) | ||||
| C(2,0) | ||||
| C(3,0) | ||||
| ... |
Finalmente, Pascal notó que las demás casillas del arreglo también son coeficientes binomiales:
| C(0,0) | C(1,1) | C(2,2) | C(3,3) | ... |
| C(1,0) | C(2,1) | C(3,2) | C(4,3) | ... |
| C(2,0) | C(3,1) | C(4,2) | C(5,3) | ... |
| C(3,0) | C(4,1) | C(5,2) | C(6,3) | ... |
| ... | ... | ... | ... | ... |
Cuando se listan las entradas de forma triangular como en la figura, es posible enunciar este resultado como
|
La afirmación de que las entradas del triángulo de Pascal son precisamente los coeficientes binomiales, se basa en la siguiente identidad, conocida ahora como identidad de Pascal o teorema de Pascal.
|
[editar] Prueba del teorema de Pascal
Si bien puede probarse el teorema de Pascal por medio de manipulaciones algebraicas de la fórmula con factoriales, una prueba puramente combinatoria es mucho más sencilla, proporcionando un ejemplo elegante del enfoque y técnicas de la combinatoria.
Como ejemplo, se verificará el Teorema de Pascal cuando n=5, k=3. El lado izquierdo de la identidad cuenta el número de formas de escoger 3 elementos a partir de un conjunto de 5 elementos. Supongamos ahora que el primer objeto se colorea de rojo y los demás azules. Al escoger los 3 objetos, hay dos casos:
- Entre los objetos escogidos se incluye el objeto rojo.
- Todos los objetos escogidos son azules.
Ambos casos cubren la totalidad de subconjuntos con 3 elementos, por tanto su suma debe ser igual a 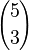 .
.
Para contar el primer caso, dado que el objeto rojo tiene que estar incluido, sólo es necesario escoger 2 objetos entre los 4 azules restantes, lo cual puede efectuarse de 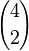 formas.
formas.
En el segundo caso, puesto que el objeto rojo no ha sido seleccionado, se debe escoger 3 elementos entre los 4 azules. El número de formas de hacer esta elección es 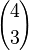 .
.
Concluimos entonces que el número total de subconjuntos con 3 elementos, 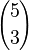 , es igual al número de subconjuntos del primer caso,
, es igual al número de subconjuntos del primer caso, 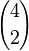 sumado al número de subconjuntos incluidos en el segundo caso,
sumado al número de subconjuntos incluidos en el segundo caso, 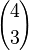 , es decir:
, es decir:
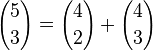 .
.El caso general se obtiene de forma similar, marcando un elemento particular, para luego dividir el conteo en dos casos, dependiendo si el elemento marcado está incluido o no. Cuando se incluye el elemento marcado falta escoger k-1 objetos de los n-1 no marcados, mientras que cuando no se incluye, hay que escoger k objetos de los n-1 marcados, concluyendo que
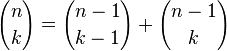 .
.[editar] Identidades que involucran coeficientes binomiales
Existe una cantidad muy grande de identidades que involucran coeficientes binomiales. El teorema de Pascal es un primer ejemplo de identidad relativa a coeficientes binomiales, a continuación se analizarán algunas pocas de las más conocidas. Son de particular interés puesto que sus pruebas proporcionan nuevamente ejemplos de razonamiento combinatorio, el cual no es usualmente presentado al tratar el tema pues por lo general, en los pocos casos en que se dan razones sobre su origen, se limitan a simples manipulaciones de la definición algebraica.
[editar] Identidad de simetría
La primera identidad a considerar es una identidad de simetría que establece
|
Por ejemplo, C(12,5) = 792 = C(12,7). Es una propiedad de simetría porque equivale a la afirmación de que el triángulo de Pascal es simétrico respecto a su eje vertical. Es común remitirse a la fórmula de factoriales para verificar su veracidad.
La interpretación combinatoria de la identidad de simetría es la afirmación de que al escoger un subconjunto automáticamente se determina su complemento, por lo que hay la misma cantidad de subconjuntos con k elementos que subconjuntos con n-k elementos.
Por ejemplo, si se tiene un conjunto con 5 elementos, de los cuales se desea pintar 3 de rojo, es posible hacer la selección de C(5,3)=10 formas. Pero cada selección automáticamente determina 2 objetos que no fueron escogidos. Así, hay una correspondencia entre selecciones de 3 objetos y selecciones de 2. La conclusión es que debe haber el mismo número de formas de hacer una u otra selección, es decir:
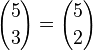 .
.[editar] Número total de subconjuntos posibles
Otra identidad muy famosa se refiere a la cantidad de subconjuntos que puede tener un conjunto dado. Esta identidad establece
|
Por ejemplo, si n=5:
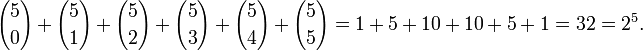
Frecuentemente, la demostración de la identidad se reduce a «sustituir x=1, y=1 en el teorema de Newton», aunque tal prueba impide entender la idea central detrás del resultado.
Partamos de un conjunto de 5 elementos. La suma 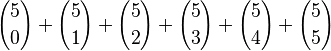 cuenta el número total de subconjuntos posibles, ya que
cuenta el número total de subconjuntos posibles, ya que
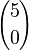 es el número de subconjuntos vacíos (sólo hay uno).
es el número de subconjuntos vacíos (sólo hay uno).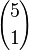 es el número de subconjuntos con un elemento.
es el número de subconjuntos con un elemento.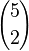 es el número de subconjuntos con dos elementos.
es el número de subconjuntos con dos elementos.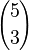 es el número de subconjuntos con tres elementos.
es el número de subconjuntos con tres elementos.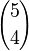 es el número de subconjuntos con cuatro elementos.
es el número de subconjuntos con cuatro elementos.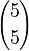 es el número de subconjuntos con cinco elementos (sólo hay uno, el conjunto total).
es el número de subconjuntos con cinco elementos (sólo hay uno, el conjunto total).
La veracidad de la identidad quedará establecida si al contar el número total de subconjuntos de una forma distinta, se obtiene que tal cantidad es 25.
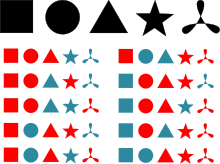
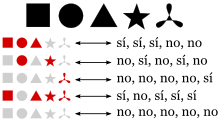
Supongamos que el conjunto original es {A, B, C, D, E}. Cada subconjunto está en correspondencia con una serie de 5 opciones sí/no:
El subconjunto {A, C, D} corresponde a la serie «sí, no, sí, sí, no», ya que en el subconjunto sí están incluidos el primer, tercer y cuarto elementos del conjunto original, mientras que no están incluidos el segundo y el quinto elemento.Del mismo modo, dada una sucesión de 5 opciones sí/no, es posible recuperar el conjunto que le da origen:
A la serie «sí, sí, no, no, sí» le corresponde el subconjunto {A, B, E}.Por tanto, al corresponder cada subconjunto con una serie de sí/no, se tiene que el número de subconjuntos es igual al número de series posibles. Sin embargo, el número de formas de hacer 5 elecciones, cada una con 2 opciones, es 2×2×2×2×2 = 25.
La prueba del caso general con conjuntos de cualquier tamaño es directa. Cada subconjunto corresponde a una sucesión de n opciones «sí/no», habiendo 2×2×···×2=2n diferentes sucesiones.
[editar] Notas al pie
- ↑ La forma C(n,k) se prefiere cuando no se dispone de medios para representar índices o no se dispone de símbolos matemáticos (por ejemplo, en el texto de un e-mail), sin embargo, la tercera forma es la más común en entornos académicos y textos sobre el tema
[editar] Referencias
- Quinn, Benjamin Arthur T.; Quinn, Jennifer J. (2003). Proofs that Really Count: The art of combinatorial proof. The Mathematical Association of America. ISBN 0-88385-333-7.
- Graham, Ronald L.; Knuth, Donald. E y Patashnik, Oren. (1994). Concrete Mathematics (2a ed. edición). ISBN 0-201-55802-5.

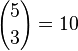 , pues hay 10 formas de escoger (en rojo) 3 objetos a partir de un conjunto con 5 elementos
, pues hay 10 formas de escoger (en rojo) 3 objetos a partir de un conjunto con 5 elementos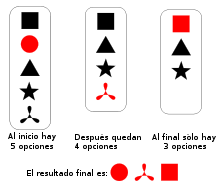
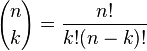
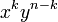 obtenido al desarrollar
obtenido al desarrollar 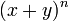
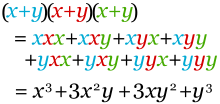
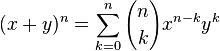 .
.


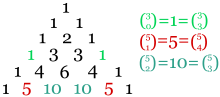
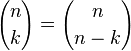 .
.
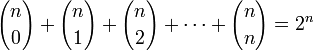 .
.
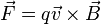
 es la
es la  es el
es el 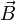 es el
es el 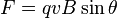 donde
donde 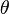 es el ángulo entre los vectores
es el ángulo entre los vectores 

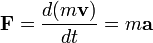
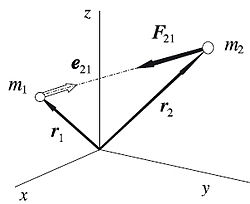
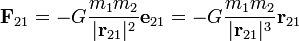
 es la fuerza que actúa sobre el cuerpo 2, ejercida por el cuerpo 1.
es la fuerza que actúa sobre el cuerpo 2, ejercida por el cuerpo 1.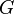
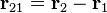
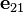 es el versor dirigido hacía 2 desde 1.
es el versor dirigido hacía 2 desde 1.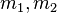 masas de los cuerpos 1 y 2.
masas de los cuerpos 1 y 2.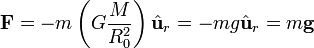
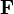 es la fuerza del cuerpo de gran masa ("planeta") sobre el cuerpo pequeño.
es la fuerza del cuerpo de gran masa ("planeta") sobre el cuerpo pequeño.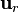 es un versor cuya dirigido desde el centro del "planeta" al del cuerpo de pequeña masa.
es un versor cuya dirigido desde el centro del "planeta" al del cuerpo de pequeña masa.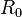 es la distancia entre el centro del "planeta" y el del cuerpo pequeño..
es la distancia entre el centro del "planeta" y el del cuerpo pequeño..
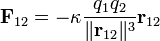
 es la fuerza ejercida por la carga 1 sobre la carga 2.
es la fuerza ejercida por la carga 1 sobre la carga 2. una constante que dependerá del sistema de unidades para la carga.
una constante que dependerá del sistema de unidades para la carga.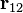
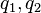 valor de las cargas.
valor de las cargas.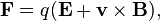
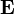 es el campo eléctrico.
es el campo eléctrico.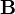 es el campo magnético.
es el campo magnético.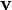 es la velocidad de la partícula.
es la velocidad de la partícula.![mathbf{F} = frac{d}{dt}left( frac{mmathbf{v}}{sqrt{1-frac{v^2}{c^2}}}right) = frac{mmathbf{v}}{left[1-frac{v^2}{c^2}right]^{3/2}} left( frac{mathbf{v}}{c^2}cdot mathbf{a} right) + frac{mmathbf{a}}{sqrt{1-frac{v^2}{c^2}}}](https://petalofucsia.blogia.com/upload/externo-cd054dad37f89cfdc3c9f34599ad390b.png)
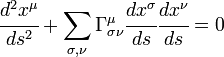
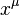 son las coordenadas de posición de la partícula.
son las coordenadas de posición de la partícula. el parámetro de arco, que es proporcional al
el parámetro de arco, que es proporcional al 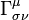 son los
son los 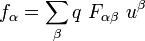
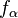 son las componentes covariantes de la
son las componentes covariantes de la 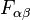 son las componentes del
son las componentes del 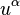 son las componentes de la
son las componentes de la 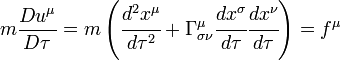
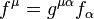 son las componentes contravarianetes de la cuadrifuerza electromagnética sobre la partícula.
son las componentes contravarianetes de la cuadrifuerza electromagnética sobre la partícula.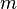 es la masa de la partícula.
es la masa de la partícula.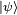 que en general representa a todo el sistema en conjunto y no puede separarse en partes. Sólo para sistemas donde el estado del sistema pueda descomponerse de manera no ambigua en la forma
que en general representa a todo el sistema en conjunto y no puede separarse en partes. Sólo para sistemas donde el estado del sistema pueda descomponerse de manera no ambigua en la forma 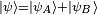 donde cada una de esas dos partes representa una parte del sistema es posible definir el concepto de fuerza. Sin embargo en la mayoría de sistemas interesanes no es posible esta descomposición. Por ejemplo si consideramos el conjunto de electrones de un átomo, que es un conjunto de
donde cada una de esas dos partes representa una parte del sistema es posible definir el concepto de fuerza. Sin embargo en la mayoría de sistemas interesanes no es posible esta descomposición. Por ejemplo si consideramos el conjunto de electrones de un átomo, que es un conjunto de 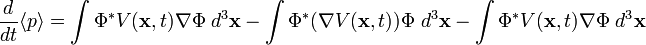
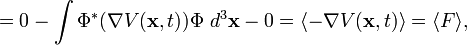
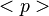 es el valor esperado del momento lineal de la partícula.
es el valor esperado del momento lineal de la partícula.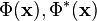 es la función de onda de la partícula y su compleja conjugada.
es la función de onda de la partícula y su compleja conjugada.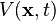 es el potencial del que derivar las "fuerzas".
es el potencial del que derivar las "fuerzas". denota el
denota el 
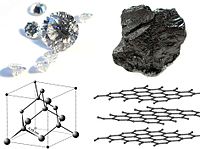








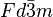 ), consistente en átomos de carbono en disposición tetraédrica unidos de forma covalente. Una segunda forma, llamada lonsdaleíta, tiene
), consistente en átomos de carbono en disposición tetraédrica unidos de forma covalente. Una segunda forma, llamada lonsdaleíta, tiene