CIENCIA3: DATACIÓN POR RADIOCARBONO. La datación por radiocarbono es un método de datación radiométrica que utiliza el isótopo carbono-14 (14C) para determinar la edad de materiales que contienen carbono hasta unos 60.000 años.[1] Dentro de la arqueología es considerada una técnica de datación absoluta. En 1946 el químico americano Willard Libby.[2] dio a conocer los mecanismos de formación del isótopo 14C a través de reacciones nucleares en la atmósfera. Más tarde, en 1949, cuando ocupaba su cargo como profesor en la universidad de Chicago desarrolló el conocido Método de Datación Radiocarbónica. En 1960, Libby fue galardonado con el Premio Nobel de química por su método de datación mediante el carbono 14.
Datación por radiocarbono
De Wikipedia, la enciclopedia libre


La datación por radiocarbono es un método de datación radiométrica que utiliza el isótopo carbono-14 (14C) para determinar la edad de materiales que contienen carbono hasta unos 60.000 años.[1]
Dentro de la arqueología es considerada una técnica de datación absoluta. En 1946 el químico americano Willard Libby.[2] dio a conocer los mecanismos de formación del isótopo 14C a través de reacciones nucleares en la atmósfera. Más tarde, en 1949, cuando ocupaba su cargo como profesor en la universidad de Chicago desarrolló el conocido Método de Datación Radiocarbónica. En 1960, Libby fue galardonado con el Premio Nobel de química por su método de datación mediante el carbono 14.
Contenido[ocultar] |
[editar] Química básica
En la naturaleza hay tres isótopos naturales del Carbono, dos de ellos, el carbono-12 (12C) y el carbono-13 (13C), son estables y un tercero, el carbono-14, (14C) es inestable o radiactivo. La abundancia natural del carbono-12 y del carbono-13 es 98,89% y 1,11% respectivamente, mientras que la del carbono-14 es de 1,0 . 10-10 %. El carbono-14 tiene un periodo de semidesintegración de 5730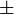 40 años y podría haber desaparecido de la tierra hace mucho tiempo si no fuera por los constantes impactos de rayos cósmicos sobre el nitrógeno en la Atmósfera de la Tierra, donde se forman más isótopos. (De hecho el mismo proceso ocurre en la atmósfera rica en nitrógeno del satélite de Saturno Titan.) Cuando los rayos cósmicos entran en la atmósfera, provocan varias reacciones nucleares, algunas de las cuales producen neutrones. Los neutrones resultantes reaccionan con algunos átomos de la moléculas de nitrógeno(N2) en la atmósfera:
40 años y podría haber desaparecido de la tierra hace mucho tiempo si no fuera por los constantes impactos de rayos cósmicos sobre el nitrógeno en la Atmósfera de la Tierra, donde se forman más isótopos. (De hecho el mismo proceso ocurre en la atmósfera rica en nitrógeno del satélite de Saturno Titan.) Cuando los rayos cósmicos entran en la atmósfera, provocan varias reacciones nucleares, algunas de las cuales producen neutrones. Los neutrones resultantes reaccionan con algunos átomos de la moléculas de nitrógeno(N2) en la atmósfera:
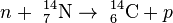
La tasa más alta de producción de carbono-14 tiene lugar en altitudes entre 9 y 15 km (30,000 y 50,000 ft), y en altas latitudes geomagnéticas, pero el carbono-14 se esparce uniformemente sobre la atmósfera y reacciona con el oxígeno para formar dioxido de carbono. Este dioxido de carbono también es absobido por los océanos, disolviéndose en el agua. De forma aproximada se puede considerar que el flujo de rayos cósmicos es constante durante largos períodos, y, por tanto, que el 14C se produce a un ritmo constante. De esta forma, la proporción de carbono radiactivo y no radiactivo permanece constante en la atmósfera. Esta proporción es de aproximadamente 1 parte por billón (6·109 átomos por mol). En 1958, Hessel de Vries[3] demostró que la concentracion de 14C en la atmósfera varía con el tiempo y de forma local. Así, para las dataciones más precisas, estas variaciones son tenidas en cuenta mediante curvas de calibración. Cuando se usan estas curvas de calibración, su precisión y forma son las que determinan la precisión de la datación realizada.
El proceso de fotosíntesis incorpora el átomo radiactivo en las plantas de manera que la proporción 14C/12C en éstas es similar a la atmosférica. Los animales incorporan, por ingestión, el carbono de las plantas. Ahora bien, tras la muerte de un organismo vivo no se incorporan nuevos átomos de 14C a los tejidos y la concentración del isótopo va decreciendo conforme va transformándose en 14N por decaimiento radiactivo:
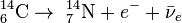
[editar] Cálculo de edades
El 14C decae de forma exponencial, es decir, la tasa de decaimiento disminuye de forma proporcional al número de átomos restante. La ecuación diferencial tiene la forma:
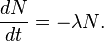
cuya solución es:
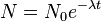 ,
,donde
N0 = número de átomos de 14C en el momento t = 0, o sea el momento inicial en el que se empieza a contar el número de desintegraciones,N = número de átomos restante después de que haya transcurrido un tiempo t,λ = constante de desintegración radiactiva, la probabilidad de desintegración por unidad de tiempo.La constante de desintegración radiactiva se relaciona con la vida media y el periodo de semidesintegración de forma:
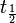 =
= 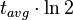 = semivida. Para el 14C:
= semivida. Para el 14C: 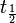 = 5568 years.[4]
= 5568 years.[4]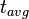 =
=  = vida media. Para el 14C:
= vida media. Para el 14C: 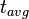 = 8033 años.
= 8033 años.Los resultados obtenidos por este método se suelen dar en años antes del presente (years BP, en inglés), lo que significa que t(BP)=-t. Teniendo esto en cuenta, la edad (sin corregir) de una muestra vendrá dada por:
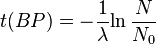
O, equivalentemente:
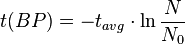
y
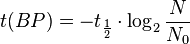
Una vez obtenida la edad radiológica (medida en años de radiocarbono) de la muestra, se procede a obtener la edad cronológica mediante las correspondientes curvas de calibración[cita requerida].
[editar] Medidas y escalas
Las medidas se hacen tradicionalmente contando la desintegración radiactiva de átomos individuales de carbono por recuento proporcional gaseoso o por recuento de centelleo líquido, pero estas dos técnicas son relativamente insensibles y están sujetas a relativamente grandes incertidumbres estadísticas cuando las muestras son pequeñas (menores de 1g de carbono). Si hay poco carbono al comenzar, una semivida que dura mucho significa que solo unos pocos átomos se desintegran mientras se intenta su detección (4 atoms/s) /mol tan solo después de la muerte, de este modo, p ej: 1 (atom/s)/mol después de 10,000 años). La sensibilidad ha sido incrementada usando técnicas basadas en espectrometría de masas (AMS), donde todos los átomos de 14C pueden ser contados directamente, no solamente aquellos que se desintegran durante el intervalo de recuento asignado para cada análisis. La técnica de AMS permite datar muestras que contienen tan solo unos pocos miligramos de carbono.
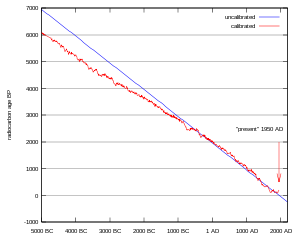
Las edades de radiocarbono brutas (es decir, aquellas no calibradas), lo que se conoce por edad radiocarbónica o de 14C, se expresan en años BP (Before Present- Hasta hoy día). Esta escala equivale a los años transcurridos desde la muerte del ejemplar hasta el año 1950 de nuestro calendario, siendo este el número de años de radiocarbono antes de 1950, basadas en un nominal (y asumiendo como constante) el nivel de carbono-14 en la atmósfera igual al nivel de 1950. Se elige esta fecha por convenio y porque en la segunda mitad del siglo XX, los ensayos nucleares provocaron severas anomalías en las curvas de concentración relativa de los isótopos radiactivos en la atmósfera.
Los laboratorios de datación normalmente proporcionan la desviación estándar. Normalmente, para el cálculo de esta desviación estándar solo se tienen en cuenta los errores estadísticos de conteo. Sin embargo, algunos laboratorios proporcionan un multiplicador del error para tener en cuenta otras fuentes de error. Más recientemente, se intenta determinar el error global de la medida, usando muestras de control de edad conocida y verificadas por comites internacionales.[6] A fecha de 2008, es posible datar una muestra de menos de 10000 años con una precisión mejor que 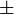 40 años de radiocarbono. Este error, sin embargo es sólo una parte del error de la datación cronológica.
40 años de radiocarbono. Este error, sin embargo es sólo una parte del error de la datación cronológica.
[editar] Calibración
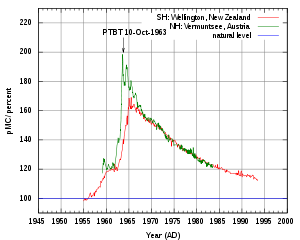
La edad radiológica no puede ser usada directamente como edad cronológica, ya que, como se ha dicho anteriormente, la concentración de 14C en la atmósfera no es estríctamente constante. Esta concentración varía en función de los cambios producidos en la intensidad de la radiación cósmica, que, a su vez, se ve afectada por variaciones en la magnetosfera terrestre y en la actividad solar. Además, existen importantes reservas de carbono en forma de materia orgánica, disuelta en los oceanos, en sedimentos oceánicos (hidratos de metano) y rocas sedimentarias. Cambios en el clima terrestre afectan a los flujos de carbono entre estas reservas y la atmósfera, alterando la concentración de 14C en esta.
Además de estos procesos naturales, la actividad humana también es responsable de parte de estos cambios. Desde el principio de la revolución industrial en el siglo XVIII hasta los años 50 del siglo XX, la concentración de 14C disminuyó como consecuencia de la emisión de grandes cantidades de CO2 como consecuencia de la actividad industrial y la quema de grandes cantidades de carbón y petroleo. Esta disminución es conocida como efecto Suess, y afecta también a la concentración de 13C. Sin embargo, entre los años 50 y 60, la concentración de 14C se duplicó como consecuencia de las pruebas nucleares atmosféricas realizadas en esos años. A mediados de los años 90, el nivel de 14C en la atmósfera era un 20% superior al de 1950. Es por esto que se toman como patrón de referencia las reservas de ácido oxálico almacenadas en el National Institute of Standards cuyo contenido de radiocarbono se considera igual al de una muestra de madera de 1950[4].
[editar] Métodos de medida
Actualmente se emplean básicamente tres tecnicas diferentes para medir el contenido de radiocarbono en una muestra: con un contador proporcional de gas; con un contador de centelleo líquido; y mediante espectrometría de masas con acelerador[5].
En el primer caso, el carbono obtenido en la muestra se convierte en CO2 y se introduce en un contador proporcional de gas, mide el número de desintegraciones producidas en la muestra. Esta es la técnica original desarrollada por Libby. Tiene el inconveniente de que, dada la baja actividad del 14C y la pequeñísima concentración en la muestra, los contadores actuales sólo son capaces de detectar alrededor de 3 desintegraciones por segundo y mol en una muestra típica. Dado que el error estadístico de la medida es inversamente proporcional a la raiz cuadrada del número de desintegraciones medidas (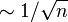 ), es necesario un tiempo muy largo de medición así como muestras más grandes (en torno a 1Kg). Además es necesario un mayor blindaje del detector para protegerlo de la radiactividad natural.
), es necesario un tiempo muy largo de medición así como muestras más grandes (en torno a 1Kg). Además es necesario un mayor blindaje del detector para protegerlo de la radiactividad natural.
La medición con contadores de centelleo líquido se popularizaron en los años 1960. En esta técnica, la muestra se disuelve en benceno y se le añade un líquido que centellea cuando se produce una desintegración. Los contadores de centelleo líquido tienen la ventaja de que tienen un rendimiento mayor que los proporcionales de gas. Sin embargo, aún están afectados por el problema de la baja actividad del 14C y de la radiación ambiental.
La espectrometría de masas con acelerador es el método más moderno. En ella, la muestra es ionizada e introducida en un acelerador de partículas. El haz resultante es desviado por potentes campos magnéticos. Dado que el cada isótopo de carbono tiene una masa diferente, el ángulo de deflexión es ligeramente diferente para cada uno y es posible medir las concentraciones relativas de cada uno de ellos. Al no depender de la actividad de la muestra y ser insensible a la radiactividad natural, con este método se pueden conseguir las medidas de mayor calidad. Se pueden medir concentraciones de hasta 10-15 y se necesitan muestras mucho más pequeñas (de hasta 1mg). Así, por ejemplo, en una muestra de 1mg que contenga sólo 40000 átomos de 14C, se puede obtener una precisión del 0.5%, lo que representa un error de unos 40 años.
[editar] Véase también
[editar] Referencias
- ↑ Plastino, W., Kaihola, L., Bartolomei, P. y Bella, F. (2001) Cosmic background reduction in the radiocarbon measurement by scintillation spectrometry at the underground laboratory of Gran Sasso, Radiocarbon, 43: 157–161
- ↑ Libby, W. F. (1946). «Atmospheric helium-three and radiocarbon from cosmic radiations.». Phys. Rev., 69: pp. 671-672.
- ↑ de Vries, H. (1958). «Variation in the concentration of radiocarbon with time and location on Earth.». Proc. Koninkl. Ned. Acad. Wetenschap. B61: pp. 257-281.
- ↑ Libby, WF. Radiocarbon dating. Second ed. (Univ. Chicago Press, 1955)
- ↑ Stuiver, M., Reimer, P. J. y Braziunas, T. F. (1998) Datación por carbono-14 de alta precisión para muestras terrestres y marinas. Radiocarbon, 40: 1127-1151
- ↑ Scott, EM (2003). «The Fourth International Radiocarbon Intercomparison (FIRI).». Radiocarbon 45: pp. 135–285.
[editar] Bibliografía
Faure, G. y Mensing, T.M. (2005). “Isotopes principles and applications”, 3rd edition, John Wiley & Sons, Inc, Hoboken, New Jersey.
Renfrew, Colin y Bahn, Paul (1998). “Arqueología, Teorías, Métodos y Práctica”, 2ªEd. Ediciones Akal, S.A. Sector Foresta, 1. 28760 Tres Cantos
0 comentarios