MAQUINARIA, VEHÍCULOS: CUATRIMOTOS O QUADS. Una cuadrimoto, cuadriciclo, cuatriciclo o quad (en inglés all-terrain vehicle o ATV) es un vehículo de cuatro ruedas parecido a una motocicleta. El quad procede de los primeros triciclos o hart-trick, los cuales disponían de dos ruedas traseras y una delantera, con los consecuentes problemas de estabilidad y seguridad, además de la falta de propulsor. A pesar de ser lo mismo, se designan ATV a los vehículos de uso recreacional o para tareas agrícolas, mientras que el concepto Quad es utilizado cuando su función se aproxima más hacia la deportividad.
Cuatrimoto
Este artículo o sección sobre transporte necesita ser wikificado con un formato acorde a las convenciones de estilo.
|
Una cuadrimoto, cuadriciclo, cuatriciclo o quad (en inglés all-terrain vehicle o ATV) es un vehículo de cuatro ruedas parecido a una motocicleta. El quad procede de los primeros triciclos o hart-trick, los cuales disponían de dos ruedas traseras y una delantera, con los consecuentes problemas de estabilidad y seguridad, además de la falta de propulsor. A pesar de ser lo mismo, se designan ATV a los vehículos de uso recreacional o para tareas agrícolas, mientras que el concepto Quad es utilizado cuando su función se aproxima más hacia la deportividad.
Los ATV/Quads, son vehículos muy especiales por su rendimiento, fiabilidad y respuesta a distintas exigencias de diferentes tipos de usuarios. Potencia, agilidad y resistencia son algunas de las principales cualidades de estas máquinas. Los ATV/Quads son multifuncionales, en cuanto a sus prestaciones y pueden vérseles trepando angostos, circulando sobre superficies arenosas, cruzando arroyos o atravesando frondosos bosques. La ligereza y fiabilidad de estos vehículos los hacen capaces de superar terrenos donde otros vehículos no deben adentrarse o no pueden hacerlo. Un potente motor y una flexible combinación de la caja de cambios automática son características deseables para este tipo de vehículos.
Contenido[ocultar] |
[editar] Historia de la cuatrimoto
Hace más de treinta años, los distribuidores de motocicletas, cansados de experimentar cómo dejaban de vender sus vehículos cuando llegaba el mal tiempo, solicitaron a los fabricantes que creasen un producto capaz de circular en condiciones climáticas adversas. Aunque las primeras ideas se basaban en el concepto de motocicleta por su fácil manejabilidad y poco peso, estos proyectos se descartaron ya que las dos ruedas nunca representarían seguridad ante terrenos de baja adherencia. Fue por este motivo, por el que comenzaron a pensar en vehículos de tres, cuatro y hasta seis ruedas.
Se trataba por tanto de unir en un mismo concepto la manejabilidad de una motocicleta y la estabilidad de los vehículos de más de dos ruedas. Así, fue como en 1970 nacieron los triciclos motorizados, popularmente conocidos como Trike. Este tipo de vehículos se popularizaron de tal forma que en pocos años se habían extendido de forma masiva en Estados Unidos. Sin embargo, fue precisamente esta masificación la causa de la desaparición de los ‘trikes’. El elevado número de accidentes, bien por exceso de velocidad o bien por la inexperiencia de sus conductores, llevó a la Asociación de Consumidores Norteamericana a presentar una serie de informes ante el Gobierno estadounidense confirmando la peligrosidad del vehículo. Este hecho, obligó a los fabricantes a alcanzar un acuerdo para que se dejaran de fabricar los Trikes en 1988.
A pesar de que los Trikers murieron a finales de los 80, su ‘almas’ se reencarnaron en otro tipo de vehículos. Fue ahí cuando surgieron los ATV/Quads, principalmente en zonas agrícolas. Estos vehículos mantenían por tanto la filosofía de las motocicletas (ligeros y manejables) al mismo tiempo que eran válidos en cualquier terreno y ante las condiciones climatológicas más duras. Inicialmente, los ATV fueron utilizados en labores de ayuda del trabajo diario, para pasar unos años después a convertirse también en vehículos destinados al ocio y a la competición.
Su aparición estuvo ligada inicialmente al mercado norteamericano y japonés. En la actualidad, en Estados Unidos circulan alrededor de siete millones de vehículos [cita requerida]. En España, el mercado ha multiplicado sus ventas en los últimos cinco años, llegando a comercializar cerca de 8000 unidades en 2002 [cita requerida], la mayoría de ellos destinados al ocio y al uso deportivo. Fue entonces, cuando se empezó a diferenciar el uso agrícola y recreacional (ATV) del más próximo a la competición (Quad).
Hoy en día es muy común ver en cualquier lugar de España un ATV e incluso disfrutar de él. Así, numerosas empresas organizan rutas o excursiones en ATV por cualquier rincón de España. También los lugares más visitados de las costas españolas se han convertido en verdaderos promotores de estos vehículos con la aparición de numerosas empresas de alquiler. Un buen ejemplo de la funcionalidad de estos vehículos es la Policía municipal de diferentes localidades almerienses y valencianas, como Gandía, que ha escogido los ATV para facilitar a los agentes la vigilancia de las playas.
[editar] Conducción
Comparten características con las motos como su ligereza, agilidad, posición de conducción, y sin embargo su estilo de conducción es más parecido al de un coche. Por muy difícil que parezca el obstáculo, para el ATV/Quad probablemente no suponga ningún problema. El manejo es sencillo salvo para los usuarios de motocicletas. Esta particularidad viene dada ya que el conductor de moto suele estar acostumbrado a mover su cuerpo para tomar la curva, mientras que para pilotar el ATV/Quad conviene hacer movimientos del manillar, ya que sólo con la inclinación, este vehículo no entrará en la curva de la forma que queremos.
La posición que hay que mantener es similar a la de la moto. Suele ser común que en lugar de un puño como acelerador se utilice un gatillo situado en el manillar. Conviene señalar que mientras el ATV/Quad está circulando nunca hay que sacar los pies e intentarlos poner en el suelo ya que la velocidad y las ruedas del eje trasero podrían jugarnos una mala pasada.
En conducción por pistas deslizantes, el pilotaje es similar al de un coche de Rallys, en el que las derrapadas (pérdida de tracción de alguna de las ruedas) suele ser habitual. Otro factor que también sucede en los virajes es que las ruedas exteriores en las curvas suelen despegarse del suelo, algo que se tiene que corregir inclinando el peso del cuerpo hacia el mismo lado de la curva.
[editar] Diferencias entre ATV y Quad
El quad es un vehículo deportivo con aspecto estilizado, veloz y va destinado a circular por pistas y circuitos. Mayoritariamente es tracción trasera con cambio manual y eje trasero rígido.Tales como el legendario banshee 350cc de yamaha.
El cuatriciclo fue hecho como vehículo de trabajo, su aspecto es más cuadrado, casi todos tienen reductoras, cambio automático, tracción a las 4 ruedas, ya sea permanente o temporal, disponen de planos de carga delante y detrás, pueden arrastrar remolques y equipos de trabajo e inclusive esta mismo puede rodar por terrenos difíciles ya que el quad es muy muy rígido y de poca estabilidad, el ATV es un poco peligroso si no se sabe manejar y controlar; pero hay cursos que permiten saber como conducir correctamente una ATV O QUAD
[editar] ¿La mala fama del quad?
| Existen desacuerdos sobre la neutralidad en el punto de vista de la versión actual de este artículo o sección. En la página de discusión puedes consultar el debate al respecto. |
Según fuentes de la AUTT, 'el perfil que define a un usuario de ATV, suele ser el de personas mayores de 10 o 12 años, respetuosos con el medio ambiente, con un objetivo claro: descubrir parajes naturales a lo largo de un recorrido que les llevará de un lugar a otro de la geografía'. Además, el precio de los ATV es superior al de los quads, por lo que sus usuarios suelen situarse en un nivel económico medio-alto. Además, el quad es un vehículo que, por sus características, está destinado a la competición, es decir, a las carreras.
Desde las asociaciones de usuarios de ATV se extiende la queja de que no se diferencie claramente entre conductores de quad y de ATV. Este malestar, según la AUTT, se debe a que recientemente 'el colectivo de quads está creando una imagen que no se corresponde con la de la mayoría, lo que preocupa a los usuarios de ATV, que no se sienten ni quieren ser identificados dentro del mismo grupo'.
Esta 'mala fama' de algunos 'quadtreros', que perjudica a los conductores de ATV (y a los los quads también), ya se ha materializado en medidas de control que afectan a ambos en algunas zonas de Andalucía, como la aldea de Almonte en el Rocío, en la que está prohibido circular con estos vehículos, o en San Fernando, Cádiz, donde la policía tuvo que endurecer el pasado año las medidas de control sobre dichas motos.
Los quadtreros reclaman el derecho a no ser tratados como potenciales delincuentes por el mero hecho de conducir un determinado tipo de vehículo. El quad está en este momento en el ojo del huracán. Por supuesto que, como ocurre siempre, por culpa de una minoría. Pero una minoría que no podemos ocultar que existe. Que ha crecido exponencialmente... y que está siendo la culpable indirecta -o directa, según se mire- de la caída en picado del otrora floreciente mercado quad y ATV.
La moto de montaña tiene, desgraciadamente, su cuota de descerebrados pero presenta dos filtros obvios y naturales que impide que lleguen aún más al colectivo: se necesita carnet de moto... y uno se cae si no sabe conducir. Pero el quad... el quad es estupendo porque para conducirlo basta el carnet de coche y uno no se cae... El mal ya estaba hecho: la combinación “mala educación” de algunos usuarios con “acceso fácil a un vehículo molón” resultaba explosiva.
La Administración cobraba sus impuestos y sus licencias de explotación mirando hacia otro lado... hasta que la bola se hizo grande y acabó como acaban siempre estas cosas: culpabilizando, sancionando y prohibiendo. Sorprendidas por el éxito inesperado de un producto que siempre había sido minoritario, las marcas se dejaron llevar por el dinero fácil, sin hacer memoria histórica ni autocrítica.
Cuando un quad hace una imprudencia sale en todas las televisiones y periódicos como si fuera una gran catástrofe y en cambio no se hace ni caso de iniciativas como la quedada infantil de quads, las carreras del campeonato nacional de quads, las excursiones y cursos varios que se organizan por todo el territorio nacional, las rutas por el extranjero, la aportación a la limpieza de algunas zonas de montaña,… etc.
La gente vinculada desde hace muchos años al mundo del off road coinciden en lo mismo, gente mala hay en todos los colectivos y siempre pagaran justos por pecadores.
[editar] Legislación
[editar] En Chile
Ley Según lo publicado en el Diario Oficial de Chile:
- Usar casco reglamentario, sujeto a la barbilla mediante hebillas o trabas que lo aseguren a la cabeza (certificados por alguna norma internacional como la DOT de Estados Unidos; EU, de Europa, e IJI, de Japón).
- Usar protección ocular, la que podrá consistir en anteojos o ser parte integrante del casco.
- Usar guantes de material resistente al roce que cubran la mano completa, incluyendo los dedos.
- Usar calzado cerrado que cubra el pie, preferentemente con planta antideslizante.
- Usar ropa que cubra totalmente piernas y brazos, preferentemente de material resistente al roce, al circular en vías con velocidad máxima de 80 km/h o superiores.
[editar] En España
Para conducir un ATV/Quad en España, es necesario sacar el carnet para motos o dependiendo, el de coche. El casco es obligatorio. A partir del 1 de septiembre de 2006 el uso del casco es obligatorio también en los Quad homologados como Vehículos Especiales. Los cuadriciclos ligeros (también denominados microcoches o «coches sin carnet») pueden conducirse con licencia de ciclomotor.
Existen tres tipos de homologaciones:
- Vehículo especial: Se debe circular por el arcén de la derecha.
- Ciclomotor: Pueden circular por todo tipo de carreteras, excepto autovías o autopistas y por el arcén derecho si existe y fuera practicable invadiendo en todo caso la porción mínima de calzada posible.
- Cuadriciclo Ligero: Se debe atener a la legislación de los ciclomotores.
La velocidad máxima es en España de 45 km/h para ciclomotores y cuadriciclos. Si el ATV/Quad puede alcanzar una velocidad de 60 km/h en llano, podrá circular a una velocidad no superior a 70 km/h (exceptuando los vehículos homologados como cuadriciclos). En la parte posterior del vehículo se debe indicar la velocidad máxima a la que puede circular. Es necesario conducir, como mínimo, con el seguro de responsabilidad civil obligatorio.
[editar] Fabricantes
- Arctic Cat
- Bombardier Recreational Products
- Globus
- Honda
- Kawasaki Heavy Industries
- Polaris Industries
- Suzuki
- Yamaha
- Mototrans
- Kymco
[editar] Seguridad
Lanzados al mercado en la primera mitad de los años 1970, los Quad presentaron tasas alarmantes de heridas en niños y adolescentes.[1] La literatura medica afirma que los Quads presentan los mismos riesgos que las Motocicletas.[2] [3] . En Norteamérica (donde existen Quads especiales para niños) la Academia Nacional de Pediatría y la Comisión de seguridad para productos de consumo han pedido que se prohiba a los menores de 16 años el conducir o el viajar en Quads, ya que las heridas resultantes de su uso son las propias de un vehículo a motor.[4]

El gobierno estadounidense da las siguientes recomendaciones de seguridad con respecto a los Quads[5]
- Recibir instrucción sobre su manejo.
- No conducir Quads bajo el influjo de drogas.
- Llevar casco al manejarlos, así como ropa de protección similar a la de los motociclistas.
- No permitir a niños conducir Quads para adultos (en Estados Unidos existen tres categorías de Quad para tres segmentos de edades).
- No llevar nunca pasajeros en un Quad, ya que el conductor necesita mover su peso para manejarlo correctamente de acuerdo con las circunstancias del terreno. Un pasajero dificulta la movilidad del conductor, haciendo más probable un accidente. Sólo deben llevar un único pasajero los Quads diseñados para dos usuarios.
- No conducir nunca Quads sobre asfalto, ya que estan diseñados para ser manejables únicamente sobre terreno suelto: La mayor parte de los Quads tiene ruedas de baja presión y ejes traseros rígidos (y sin diferencial) que no son adecuados para circular sobre asfalto, ya que a la hora de efectuar un giro la rueda trasera interna debe patinar sobre el terreno suelto (al hacer una trayectoria más corta que la rueda externa).
en algunos paises como México y en general Latinoamerica los Quads pueden usarse en asfalto y caminos pavimentados,Sin embargo se deberan obedecer las mismas normas de transito que una motocicleta esto mismo por que es un vehiculo abierto,este mismo no suele utilizarse en trayectos a larga distancia,aunque hay excepciones.
No Obstante un buen numero de estos se han utilizado tanto para uso recreacional en pistas adaptadas on y off road asi como vehiculos utilitarios ligeros en zonas de dificil acceso,algunos vendedores tambien usan estos vehiculos como puestos ambulantes de venta de distintos productos.
[editar] Véase también
[editar] Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Cuatrimoto.Commons
Wikimedia Commons alberga contenido multimedia sobre Cuatrimoto.Commons- Revista Q Adventure Revista argentina especializada en cuatriciclos
- La fiebre del quad "La fiebre del quad" artículo en terra.es


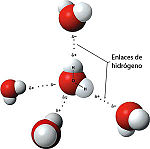

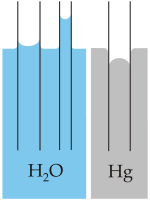


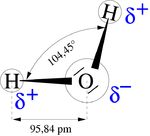

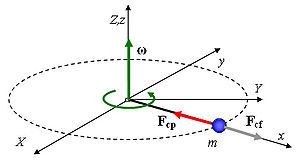
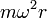 , siendo
, siendo  la distancia a la que se encuentra del eje de rotación. Así, aparentemente, la fuerza centrífuga tiende a alejar los objetos del eje de rotación.
la distancia a la que se encuentra del eje de rotación. Así, aparentemente, la fuerza centrífuga tiende a alejar los objetos del eje de rotación.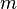 que en un sistema de referencia en rotación con una velocidad angular
que en un sistema de referencia en rotación con una velocidad angular 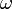 y a una distancia
y a una distancia 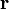 del eje de rotación viene dada por
del eje de rotación viene dada por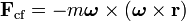
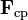 , (la tensión de la cuerda en el ejemplo ilustrado en la Figura) proporciona la aceleración centrípeta característica de todo movimiento curvilíneo.
, (la tensión de la cuerda en el ejemplo ilustrado en la Figura) proporciona la aceleración centrípeta característica de todo movimiento curvilíneo.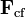 que no tiene existencia real y que sólo resulta útil al observador no-inercial para poder escribir la segunda ley de Newton en la forma usual.
que no tiene existencia real y que sólo resulta útil al observador no-inercial para poder escribir la segunda ley de Newton en la forma usual.