De Wikipedia, la enciclopedia libre

El agua en la naturaleza se encuentra en sus tres estados: líquido fundamentalmente en los océanos, sólido (hielo en los glaciares y casquetes polares así como nieve en las zonas frías) y vapor (invisible) en el aire. 
El ciclo hidrológico: el agua circula constantemente por el planeta en un ciclo continuo de evaporación, transpiración, precipitaciones, y desplazamiento hacia el mar. 
El agua es un elemento esencial para mantener nuestras vidas. El acceso a un agua potable segura nos garantiza inmunidad frente a las enfermedades. Necesidades vitales humanas como el abastecimiento de alimentos dependen de ella. Los recursos energéticos y las actividades industriales que necesitamos también dependen del agua.[1] El agua (del latín aqua) es una sustancia cuya molécula está formada por dos átomos de hidrógeno y uno de oxígeno (H2O). Es esencial para la supervivencia de todas las formas conocidas de vida. En su uso más común, con agua nos referimos a la sustancia en su estado líquido, pero la misma puede hallarse en forma sólida (hielo), y en forma gaseosa que llamamos vapor. El agua cubre el 71% de la superficie terrestre.[2] En nuestro planeta, se localiza principalmente en los océanos donde se concentra el 96,5% del agua total, los glaciares y casquetes polares tiene el 1,74%, los depósitos subterráneos en (acuíferos), los permafrost y los glaciares continentales suponen el 1,72% y el restante 0,04% se reparte en orden decreciente entre lagos, la humedad del suelo, atmósfera, embalses, ríos y seres vivos.[3]
Desde el punto de vista físico, el agua circula constantemente en un ciclo de evaporación o transpiración (evapotranspiración), precipitación, y desplazamiento hacia el mar. Los vientos transportan tanto vapor de agua como el que se vierte en los mares mediante su curso sobre la tierra, en una cantidad aproximada de 45.000 km³ al año. En tierra firme, la evaporación y transpiración contribuyen con 74.000 km³ anuales a causar precipitaciones de 119.000 km³ al año.[4]
Se estima que aproximadamente el 70% del agua dulce se consume en la agricultura.[5] El agua en la industria absorbe una media del 20% del consumo mundial, empleándose como medio en la refrigeración, el transporte y como disolvente de una gran variedad de sustancias químicas. El consumo doméstico absorbe del orden del 10% restante.[6]
El agua potable es esencial para todas las formas de vida, incluida la humana. El acceso al agua potable se ha incrementado sustancialmente durante las últimas décadas en la práctica totalidad de la superficie terrestre.[7] [8] Sin embargo estudios de la FAO, estiman que uno de cada cinco países en vías de desarrollo tendrá problemas de escasez de agua antes del 2030; en esos países es urgente un menor gasto de agua en la agricultura modernizando los sistemas de riego.[6]
Tipos de agua
El agua se puede presentar en tres estados siendo de las pocas sustancias que pueden encontrarse en sus tres estados de forma natural.[9] El agua adopta formas muy distintas sobre la tierra: como vapor de agua, conformando nubes en el aire; como agua marina, eventualmente en forma de icebergs en los océanos; en glaciares y ríos en las montañas, y en los acuíferos subterráneos su forma líquida.
El agua puede disolver muchas sustancias, dándoles diferentes sabores y olores. Como consecuencia de su papel imprescindible para la vida, el ser humano -entre otros muchos animales- ha desarrollado sentidos capaces de evaluar la potabilidad del agua, que evitan el consumo de agua salada o putrefacta. Los humanos también suelen preferir el consumo de agua fría a la que está tibia, puesto que el agua fría es menos propensa a contener microbios. El sabor perceptible en el agua de deshielo y el agua mineral se deriva de los minerales disueltos en ella; de hecho el agua pura es insípida. Para regular el consumo humano, se calcula la pureza del agua en función de la presencia de toxinas, agentes contaminantes y microorganismos. El agua recibe diversos nombres, según su forma y características:[10]

Copo de nieve visto a través de un microscopio. Está coloreado artificialmente. - Según su estado físico:
- Hielo (estado sólido)
- Agua (estado líquido)
- Vapor (estado gaseoso)
- Según su posición en el ciclo del agua:
| | Precipitación según desplazamiento | | Precipitación según estado |
| | - precipitación vertical
- precipitación horizontal (asentada)
| | - precipitación líquida
- precipitación sólida
- precipitación mixta
- con temperaturas cercanas a los 0 °C
|
- partículas en suspensión
- partículas en ascenso (impulsadas por el viento)
- según su circunstancia
- según sus usos
- agua entubada
- agua embotellada
- agua potable – la apropiada para el consumo humano, contiene un valor equilibrado de minerales que no son dañinos para la salud.
- agua purificada – corregida en laboratorio o enriquecida con algún agente – Son aguas que han sido tratadas para usos específicos en la ciencia o la ingeniería. Lo habitual son tres tipos:
- atendiendo a otras propiedades
- El agua es también protagonista de numerosos ritos religiosos. Se sabe de infinidad de ceremonias ligadas al agua. El cristianismo, por ejemplo, ha atribuido tradicionalmente ciertas características al agua bendita. Existen también otros tipos de agua que después de cierto proceso adquieren supuestas propiedades, como el agua vitalizada.
Propiedades físicas y químicas

El impacto de una gota sobre la superficie del agua provoca unas ondas características, llamadas ondas capilares. El agua es una sustancia que químicamente se formula como H2O; es decir, que una molécula de agua se compone de dos átomos de hidrógeno enlazados covalentemente a un átomo de oxígeno.
Fue Henry Cavendish quien descubrió en 1781 que el agua es una sustancia compuesta y no un elemento, como se pensaba desde la Antigüedad. Los resultados de dicho descubrimiento fueron desarrollados por Antoine Laurent de Lavoisier dando a conocer que el agua estaba formada por oxígeno e hidrógeno. En 1804, el químico francés Joseph Louis Gay-Lussac y el naturalista y geógrafo alemán Alexander von Humboldt demostraron que el agua estaba formada por dos volúmenes de hidrógeno por cada volumen de oxígeno (H2O).
Las propiedades fisicoquímicas más notables del agua son:
- El agua bloquea sólo ligeramente la radiación solar UV fuerte, permitiendo que las plantas acuáticas absorban su energía.
- La capilaridad se refiere a la tendencia del agua de moverse por un tubo estrecho en contra de la fuerza de la gravedad. Esta propiedad es aprovechada por todas las plantas vasculares, como los árboles.
- El punto de ebullición del agua (y de cualquier otro líquido) está directamente relacionado con la presión atmosférica. Por ejemplo, en la cima del Everest, el agua hierve a unos 68º C, mientras que al nivel del mar este valor sube hasta 100º. Del mismo modo, el agua cercana a fuentes geotérmicas puede alcanzar temperaturas de cientos de grados centígrados y seguir siendo líquida.[14] Su temperatura crítica es de 373.85 °C (647,14º K), su valor específico de fusión es de 0,334 kJ/g y su índice específico de vaporización es de 2,23kJ/g.[15]
- El agua es miscible con muchos líquidos, como el etanol, y en cualquier proporción, formando un líquido homogéneo. Por otra parte, los aceites son inmiscibles con el agua, y forman capas de variable densidad sobre la superficie del agua. Como cualquier gas, el vapor de agua es miscible completamente con el aire.
- El agua pura tiene una conductividad eléctrica relativamente baja, pero ese valor se incrementa significativamente con la disolución de una pequeña cantidad de material iónico, como el cloruro de sodio.
- El agua tiene el segundo índice más alto de capacidad calorífica específica -sólo por detrás del amoníaco- así como una elevada entalpía de vaporización (40.65 kJ mol-1); ambos factores se deben al enlace de hidrógeno entre moléculas. Estas dos inusuales propiedades son las que hacen que el agua "modere" las temperaturas terrestres, reconduciendo grandes variaciones de energía.

Animación de como el hielo pasa a estado líquido en un vaso. Los 50 minutos transcurridos se concentran en 7 segundos. - La densidad del agua líquida es muy estable y varía poco con los cambios de temperatura y presión. A la presión normal (1 atmósfera), el agua líquida tiene una mínima densidad (0,958 kg/l) a los 100 °C. Al bajar la temperatura, aumenta la densidad (por ejemplo, a 90 °C tiene 0,965 kg/l) y ese aumento es constante hasta llegar a los 3,8 °C donde alcanza una densidad de 1 kg/litro. Esa temperatura (3,8 °C) representa un punto de inflexión y es cuando alcanza su máxima densidad (a la presión mencionada). A partir de ese punto, al bajar la temperatura, la densidad comienza a disminuir, aunque muy lentamente (casi nada en la práctica), hasta que a los 0° disminuye hasta 0,9999 kg/litro. Cuando pasa al estado sólido (a 0 °C), ocurre una brusca disminución de la densidad pasando de 0,9999 kg/l a 0,917 kg/l.
- Como un óxido de hidrógeno, el agua se forma cuando el hidrógeno -o un compuesto conteniendo hidrógeno- se quema o reacciona con oxígeno -o un compuesto de oxígeno-. El agua no es combustible, puesto que es un producto residual de la combustión del hidrógeno. La energía requerida para separar el agua en sus dos componentes mediante electrólisis es superior a la energía desprendida por la recombinación de hidrógeno y oxígeno. Esto hace que el agua, en contra de lo que sostienen algunos rumores,[16] no sea una fuente de energía eficaz.[17]
Actualmente se sigue investigando sobre la naturaleza de este compuesto y sus propiedades, a veces traspasando los límites de la ciencia convencional.[18] En este sentido, el investigador John Emsley, divulgador científico, dijo en cierta ocasión del agua que "(Es) una de las sustancias químicas más investigadas, pero sigue siendo la menos entendida".[19]
Distribución de agua en la naturaleza
El agua en el Universo
La mayoría del agua que existe en el universo puede haber surgido como derivado de la formación de una estrella. El nacimiento de las estrellas suele causar un fuerte flujo de gases y polvo cósmico. Cuando este material colisiona con el gas de las zonas exteriores, las ondas de choque producidas comprimen y calientan el gas. Se piensa que el agua es producida en este gas cálido y denso.[20] Se ha detectado agua en nubes interestelares dentro de nuestra galaxia, la Vía Láctea. Estas nubes interestelares pueden condensarse eventualmente en forma de una nebulosa solar. Además, se piensa que el agua puede ser abundante en otras galaxias, dado que sus componentes (hidrógeno y oxígeno) están entre los más comunes del universo.[21]
Se ha detectado vapor de agua en:
El agua en su estado líquido está presente en:
- Tierra - 71% de su superficie
- Luna - en 2008 se encontraron[26] pequeñas cantidades de agua en el interior de perlas volcánicas traídas a la Tierra por la expedición del Apolo 15, de 1971.
- Encélado (luna de Saturno) y en Europa (luna de Júpiter) existen indicios de que el agua podría existir en estado líquido.
Se ha detectado hielo en:
El agua y la zona habitable

Zona habitable en el Sistema Solar donde el sol genera unas condiciones de presión y temperatura que permite la existencia de agua en sus tres estados (marcada en azul). Interpolación de la zona habitable en otros sistemas planetarios con soles de diferentes tamaños. La existencia de agua en estado líquido -en menor medida en sus formas de hielo o vapor- sobre la Tierra es vital para la existencia de la vida tal como la conocemos. La Tierra está situada en un área del sistema solar que reúne condiciones muy específicas, pero si estuviésemos un poco más cerca del Sol -un 5%, o sea 8 millones de kilómetros- ya bastaría para dificultar enormemente la existencia de los tres estados de agua conocidos.[27] La masa de la Tierra genera una fuerza de gravedad que impide que los gases de la atmósfera se dispersen. El vapor de agua y el dióxido de carbono se combinan, causando lo que ha dado en llamarse el efecto invernadero. Aunque se suele atribuir a este término connotaciones negativas, el efecto invernadero es el que mantiene la estabilidad de las temperaturas, actuando como una capa protectora de la vida en el planeta. Si la Tierra fuese más pequeña, la menor gravedad ejercida sobre la atmósfera haría que ésta fuese más delgada, lo que redundaría en temperaturas extremas, evitando la acumulación de agua excepto en los casquetes polares (tal como ocurre en Marte). Algunos teóricos han sugerido que la misma vida, actuando como un macroorganismo, mantiene las condiciones que permiten su existencia. La temperatura superficial de la tierra ha estado en relativamente constante variación a través de las eras geológicas, a pesar de los cambiantes niveles de radiación solar. Este hecho ha motivado que algunos investigadores crean que el planeta está termorregulado mediante la combinación de gases del efecto invernadero y el albedo atmosférico y superficial. Esta hipótesis, conocida como la teoría de Gaia, no es sin embargo la posición más adoptada entre la comunidad científica. El estado del agua también depende de la gravedad de un planeta. Si un planeta es lo bastante grande, el agua que exista sobre él permanecería en estado sólido incluso a altas temperaturas, dada la elevada presión causada por la gravedad.
El agua en la Tierra
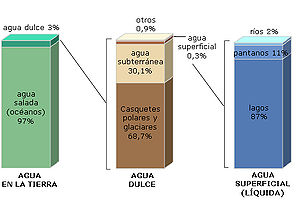
Representación gráfica de la distribución de agua terrestre.[3] 
Los océanos cubren el 71% de la superficie terrestre: su agua salada supone el 96,5% del agua del planeta.[28] 
El 70% del agua dulce de la Tierra se encuentra en forma solida (Glaciar Grey, Chile). El agua es fundamental para todas las formas de vida conocida. Los humanos consumen agua potable. Los recursos naturales se han vuelto escasos con la creciente población mundial y su disposición en varias regiones habitadas es la preocupación de muchas organizaciones gubernamentales.
El total del agua presente en el planeta, en todas sus formas, se denomina hidrosfera. El agua cubre 3/4 partes (71%) de la superficie de la Tierra. Se puede encontrar esta sustancia en prácticamente cualquier lugar de la biosfera y en los tres estados de agregación de la materia: sólido, líquido y gaseoso.
El 97 por ciento es agua salada, la cual se encuentra principalmente en los océanos y mares; sólo el 3 por ciento de su volumen es dulce. De esta última, un 1 por ciento está en estado líquido. El 2% restante se encuentra en estado sólido en capas, campos y plataformas de hielo o banquisas en las latitudes próximas a los polos. Fuera de las regiones polares el agua dulce se encuentra principalmente en humedales y, subterráneamente, en acuíferos.
El agua representa entre el 50 y el 90% de la masa de los seres vivos (aproximadamente el 75% del cuerpo humano es agua; en el caso de las algas, el porcentaje ronda el 90%).
En la superficie de la Tierra hay unos 1.386.000.000 km3 de agua que se distribuyen de la siguiente forma:[3]
Distribución del agua en la Tierra| Situación del agua | Volumen en km³ | Porcentaje |
|---|
| Agua dulce | Agua salada | de agua dulce | de agua total |
|---|
| Océanos y mares | - | 1.338.000.000 | - | 96,5 |
|---|
| Casquetes y glaciares polares | 24.064.000 | - | 68,7 | 1,74 |
|---|
| Agua subterránea salada | - | 12.870.000 | - | 0,94 |
|---|
| Agua subterránea dulce | 10.530.000 | - | 30,1 | 0,76 |
|---|
| Glaciares continentales y Permafrost | 300.000 | - | 0,86 | 0,022 |
|---|
| Lagos de agua dulce | 91.000 | - | 0,26 | 0,007 |
|---|
| Lagos de agua salada | - | 85.400 | - | 0,006 |
|---|
| Humedad del suelo | 16.500 | - | 0,05 | 0,001 |
|---|
| Atmósfera | 12.900 | - | 0,04 | 0,001 |
|---|
| Embalses | 11.470 | - | 0,03 | 0,0008 |
|---|
| Ríos | 2.120 | - | 0,006 | 0,0002 |
|---|
| Agua biológica | 1.120 | - | 0,003 | 0,0001 |
|---|
| Total agua dulce | 35.029.110 | 100 | - |
|---|
| Total agua en la tierra | 1.386.000.000 | - | 100 |
|---|
La mayor parte del agua terrestre, por tanto, está contenida en los mares, y presenta un elevado contenido en sales. Las aguas subterráneas se encuentran en yacimientos subterráneos llamados acuíferos y son potencialmente útiles al hombre como recursos. En estado líquido compone masas de agua como océanos, mares, lagos, ríos, corrientes, canales, manantiales, y estanques.
El agua desempeña un papel muy importante en los procesos geológicos. Las corrientes subterráneas de agua afectan directamente a las capas geológicas, influyendo en la formación de fallas. El agua localizada en el manto terrestre también afecta a la formación de volcanes. En la superficie, el agua actúa como un agente muy activo sobre procesos químicos y físicos de erosión. El agua en su estado líquido y, en menor medida, en forma de hielo, también es un factor esencial en el transporte de sedimentos. El depósito de esos restos es una herramienta utilizada por la geología para estudiar los fenómenos formativos sucedidos en la Tierra.
El ciclo del agua
Con ciclo del agua -conocido científicamente como el ciclo hidrológico- se denomina al continuo intercambio de agua dentro de la hidrosfera, entre la atmósfera, el agua superficial y subterránea y los organismos vivos. El agua cambia constantemente su posición de una a otra parte del ciclo de agua, implicando básicamente los siguientes procesos físicos:
- evaporación de los océanos y otras masas de agua y transpiración de los seres vivos (animales y plantas) hacia la atmósfera,
- precipitación, originada por la condensación de vapor de agua, y que puede adaptar múltiples formas,
- escorrentía, o movimiento de las aguas superficiales hacia los océanos.
La energía del sol calienta la tierra, generando corrientes de aire que hacen que el agua se evapore, ascienda por el aire y se condense en altas altitudes, para luego caer en forma de lluvia. La mayor parte del vapor de agua que se desprende de los océanos vuelve a los mismos, pero el viento desplaza masas de vapor hacia la tierra firme, en la misma proporción en que el agua se precipita de nuevo desde la tierra hacia los mares (unos 45.000 km³ anuales). Ya en tierra firme, la evaporación de cuerpos acuáticos y la transpiración de seres vivos contribuye a incrementar el total de vapor de agua en otros 74.000 km³ anuales. Las precipitaciones sobre tierra firme -con un valor medio de 119.000 km³ anuales- pueden volver a la superficie en forma de líquido -como lluvia-, sólido -nieve o granizo-, o de gas, formando nieblas o brumas. El agua condensada presente en el aire es también la causa de la formación del arco iris: La refracción de la luz solar en las minúsculas partículas de vapor, que actúan como múltiples y pequeños prismas. El agua de escorrentía suele formar cuencas, y los cursos de agua más pequeños suelen unirse formando ríos. El desplazamiento constante de masas de agua sobre diferentes terrenos geológicos es un factor muy importante en la conformación del relieve. Además, al arrastrar minerales durante su desplazamiento, los ríos cumplen un papel muy importante en el enriquecimiento del suelo. Parte de las aguas de esos ríos se desvían para su aprovechamiento agrícola. Los ríos desembocan en el mar, depositando los sedimentos arrastrados durante su curso, formando deltas. El terreno de estos deltas es muy fértil, gracias a la riqueza de los minerales concentrados por la acción del curso de agua. El agua puede ocupar la tierra firme con consecuencias desastrosas: Las inundaciones se producen cuando una masa de agua rebasa sus márgenes habituales o cuando comunican con una masa mayor -como el mar- de forma irregular. Por otra parte, y aunque la falta de precipitaciones es un obstáculo importante para la vida, es natural que periódicamente algunas regiones sufran sequías. Cuando la sequedad no es transitoria, la vegetación desaparece, al tiempo que se acelera la erosión del terreno. Este proceso se denomina desertización[29] y muchos países adoptan políticas[30] para frenar su avance. En 2007, la ONU declaró el 17 de junio como el Día mundial de lucha contra la desertización y la sequía".[31]
El océano
Evaporación del agua del océano. El océano engloba la parte de la superficie terrestre ocupada por el agua marina. Se formó hace unos 4.000 millones de años cuando la temperatura de la superficie del planeta se enfrió hasta permitir que el agua pasase a estado líquido. Cubre el 71% de la superficie de la Tierra. La profundidad media es de unos 4 km. La parte más profunda se encuentra en la fosa de las Marianas alcanzando los 11.033 m. En los océanos hay una capa superficial de agua templada (12º a 30 °C), que ocupa entre varias decenas de metros hasta los 400 o 500 metros. Por debajo de esta capa el agua está fría con temperaturas de entre 5º y -1 °C. El agua está más cálida en las zonas templadas, ecuatoriales y tropicales, y más fría cerca de los polos.
Contiene sustancias sólidas en disolución, siendo las más abundantes el sodio y el cloro que, en su forma sólida, se combina para formar el cloruro de sodio o sal común y, junto con el magnesio, el calcio y el potasio, constituyen cerca del 90% de los elementos disueltos en el agua de mar.
El océano está dividido por grandes extensiones de tierra que son los continentes y grandes archipiélagos en cinco partes que, a su vez, también se llaman océanos: océano Antártico, océano Ártico, océano Atlántico, océano Índico y océano Pacífico.
Se llama mar a una masa de agua salada de tamaño inferior al océano. Se utiliza también el término para designar algunos grandes lagos.
Mareas
Artículo principal: Marea 
Pleamar y bajamar en el puerto de la Flotte en la isla Ré (Francia). Las mareas son movimientos cíclicos de las grandes masas de agua causadas por la fuerza gravitatoria lunar y el sol, en conjunción con los océanos. Las mareas se deben a movimientos de corrientes de grandes masas de agua, como mares, que oscilan en un margen constante de horas. La marea se refleja perceptiblemente en una notable variación de la altura del nivel del mar -entre otras cosas- originado por las posiciones relativas del Sol y la Luna en combinación con el efecto de la rotación terrestre y la batimetría local. La franja de mar sometida a estos cambios -expuesta en bajamar y cubierta en pleamar- se denomina zona entre mareas y representa un nicho ecológico de gran valor.
El agua dulce en la naturaleza
El agua dulce en la naturaleza se renueva gracias a la atmósfera que dispone de 12.900 km³ de vapor de agua. Sin embargo se trata de un volumen dinámico que constantemente se está incrementando en forma de evaporación y disminuyendo en forma de precipitaciones, estimándose el volumen anual en forma de precipitación o agua de lluvia entre 113.500 y 120.000 km³ en el mundo. Estos volúmenes suponen la parte clave de la renovación de los recursos naturales de agua dulce. En los países de clima templado y frío la precipitación en forma de nieve supone una parte importante del total.[32]
El 68,7% del agua dulce existente en el mundo está en los glaciares y mantos de hielo. Sin embargo, en general, no se consideran recursos hídricos por ser inaccesibles (Antártida, Ártico y Groenlandia). En cambio los glaciares continentales son básicos en los recursos hídricos de muchos países.[32]
Las aguas superficiales engloban los lagos, embalses, ríos y humedales suponiendo solamente el 0,3% del agua dulce del planeta, sin embargo representan el 80% de las aguas dulces renovables anualmente de allí su importancia.[32]
También el agua subterránea dulce almacenada, que representa el 96% del agua dulce no congelada de la Tierra, supone un importante recurso. Según Morris los sistemas de aguas subterráneas empleados en abastecimiento de poblaciones suponen entre un 25 y un 40% del agua potable total abastecida. Así la mitad de las grandes megalópolis del mundo dependen de ellas para su consumo. En las zonas donde no se dispone de otra fuente de abastecimiento representa una forma de abastecimiento de calidad a bajo coste.[32]
La mayor fuente de agua dulce del mundo adecuada para su consumo es el Lago Baikal, de Siberia, que tiene un índice muy reducido en sal y calcio y aún no está contaminado.[33]
Efectos sobre la vida
Desde el punto de vista de la biología, el agua es un elemento crítico para la proliferación de la vida. El agua desempeña este papel permitiendo a los compuestos orgánicos diversas reacciones que, en último término, posibilitan la replicación de ADN. De un modo u otro,[34] todas las formas de vida conocidas dependen del agua. Sus propiedades la convierten en un activo agente, esencial en muchos de los procesos metabólicos que los seres vivos realizan. Desde esta perspectiva metabólica, podemos distinguir dos tipos de funciones del agua: anabólicamente, la extracción de agua de moléculas -mediante reacciones químicas enzimáticas que consumen energía- permite el crecimiento de moléculas mayores, como los triglicéridos o las proteínas; en cuanto al catabolismo, el agua actúa como un disolvente de los enlaces entre átomos, reduciendo el tamaño de las moléculas (como glucosas, ácidos grasos y aminoácidos), suministrando energía en el proceso. El agua es por tanto un medio irremplazable a nivel molecular para numerosos organismos vivos. Estos procesos metabólicos no podrían realizarse en un entorno sin agua, por lo que algunos científicos se han planteado la hipótesis de qué tipo de mecanismos -absorción de gas, asimilación de minerales- podrían mantener la vida sobre el planeta.
Es un compuesto esencial para la fotosíntesis y la respiración. Las células fotosintéticas utilizan la energía del sol para dividir el oxígeno y el hidrógeno presentes en la molécula de agua. El hidrógeno es combinado entonces con CO2 (absorbido del aire o del agua) para formar glucosa, liberando oxígeno en el proceso. Todas las células vivas utilizan algún tipo de "combustible" en el proceso de oxidación del hidrógeno y carbono para capturar la energía solar y procesar el agua y el CO2. Este proceso se denomina respiración celular.

Vegetación de un oasis en el desierto. El agua es también el eje de las funciones enzimáticas y la neutralidad respecto a ácidos y bases. Un ácido, un "donante" de ión de hidrógeno (H+, es decir, de un protón) puede ser neutralizado por una base, un "receptor" de protones, como un ión hidróxido (OH-) para formar agua. El agua se considera neutra, con un pH de 7. Los ácidos tienen valores pH por debajo de 7, mientras que las bases rebasan ese valor. El ácido gástrico (HC1), por ejemplo, es el que posibilita la digestión. Sin embargo, su efecto corrosivo sobre las paredes del esófago puede ser neutralizado gracias a una base como el hidróxido de aluminio, causando una reacción en la que se producen moléculas de agua y cloruro de sal de aluminio. La bioquímica humana relacionada con enzimas funciona de manera ideal alrededor de un valor pH biológicamente neutro de alrededor de 7.4.
Las diversas funciones que un organismo puede realizar -según su complejidad celular- determinan que la cantidad de agua varíe de un organismo a otro. Una célula de Escherichia coli contiene alrededor de un 70% de agua, un cuerpo humano entre un 60 y 70%, una planta puede reunir hasta un 90% de agua, y el porcentaje de agua de una medusa adulta oscila entre un 94 y un 98%.
Formas de vida acuáticas. Circulación vegetal
Las aguas están llenas de vida. Al parecer, las primeras formas de vida aparecieron en el agua,[35] que en la actualidad no sólo es el hábitat de todas las especies de peces y también a algunos mamíferos y anfibios. El agua es también esencial para el kelp, el plancton y las algas, que son la base de la cadena trófica submarina, y provee por tanto no sólo el medio sino el sustento de toda la fauna marina.
Los animales acuáticos deben obtener oxígeno para respirar, extrayéndolo del agua de diversas maneras. Los grandes mamíferos como las ballenas conservan la respiración pulmonar, tomando el aire fuera del agua y conteniendo la respiración al sumergirse. Los peces, sin embargo, utilizan las agallas para extraer el oxígeno del agua en vez de pulmones. Algunas especies como los dipnoos conservan ambos sistemas respiratorios. Otras especies marinas pueden absorber el oxígeno mediante respiración cutánea. El arrecife de coral se ha calificado en ocasiones como "el animal vivo más grande del mundo", y con sus más de 2.600 km de extensión es posible verlo desde el espacio.
La circulación vegetal de plantas terrestres también se efectúa gracias a determinadas propiedades del agua, que hace posible la obtención de energía a partir de la luz solar.
Efectos sobre la civilización humana
La historia muestra que las civilizaciones primitivas florecieron en zonas favorables a la agricultura, como las cuencas de los ríos. Es el caso de Mesopotamia, considerada la cuna de la civilización humana, surgida en el fértil valle del Éufrates y el Tigris; y también el de Egipto, una espléndida civilización que dependía por completo del Nilo y sus periódicas crecidas. Muchas otras grandes ciudades, como Rotterdam, Londres, Montreal, París, Nueva York, Buenos Aires, Shanghái, Tokio, Chicago o Hong Kong deben su riqueza a la conexión con alguna gran vía de agua que favoreció su crecimiento y su prosperidad. Las islas que contaban con un puerto natural seguro -como Singapur- florecieron por la misma razón. Del mismo modo, áreas en las que el agua es muy escasa, como el norte de África o el Oriente Medio, han tenido históricamente dificultades de desarrollo.[36]
Agua para beber: necesidad del cuerpo humano
El cuerpo humano está compuesto de entre un 55% y un 78% de agua, dependiendo de sus medidas y complexión.[37] Para evitar desórdenes, el cuerpo necesita alrededor de siete litros diarios de agua; la cantidad exacta variará en función del nivel de actividad, la temperatura, la humedad y otros factores. La mayor parte de esta agua se absorbe con la comida o bebidas -no estrictamente agua-. No se ha determinado la cantidad exacta de agua que debe tomar un individuo sano, aunque una mayoría de expertos considera que unos 6-7 vasos de agua diarios (aproximadamente dos litros) es el mínimo necesario para mantener una adecuada hidratación.[38] La literatura médica defiende un menor consumo, típicamente un litro de agua diario para un individuo varón adulto, excluyendo otros requerimientos posibles debidos a la pérdida de líquidos causada por altas temperaturas o ejercicio físico.[39] Una persona con los riñones en buen estado tendrá dificultades para beber demasiado agua, pero -especialmente en climas cálidos y húmedos, o durante el ejercicio- beber poco también puede ser peligroso. El cuerpo humano es capaz de beber mucha más agua de la que necesita cuando se ejercita, llegando incluso a ponerse en peligro por hiperhidratación, o intoxicación de agua. El hecho comúnmente aceptado de que un individuo adulto debe consumir ocho vasos diarios de agua no tiene ningún fundamento científico.[40] Hay otros mitos[41] sobre la relación entre agua y salud que poco a poco van siendo olvidades.[42]
Una recomendación[43] sobre consumo de agua de la Plataforma de Alimentación y Nutrición señalaba:
Una cantidad ordinaria para distintas personas es de un 1 mililitro de agua por cada caloría de comida. La mayor parte de esta cantidad ya está contenida en los alimentos preparados"
FNB, Consejo Nacional de Investigación de los Estados Unidos, 1945
La última referencia ofrecida por este mismo organismo habla de 2.7 litros de agua diarios para una mujer y 3.7 litros para un hombre, incluyendo el consumo de agua a través de los alimentos.[44] Naturalmente, durante el embarazo y la lactancia la mujer debe consumir más agua para mantenerse hidratada. Según el Instituto de Medicina -que recomienda una media de 2.2 litros/día para una mujer, y 3.0 litros/día para un varón- una mujer embarazada debe consumir 2.4 litros, y hasta 3 litros durante la lactancia, considerada la gran cantidad de líquido que se pierde durante la cría.[45] También se señala que normalmente, alrededor de un 20% del agua se absorbe con la comida, mientras el resto se adquiere mediante el consumo de agua y otras bebidas. El agua se expulsa del cuerpo de muy diversas formas: a través de la orina, las heces, en forma de sudor, o en forma de vapor de agua, por exhalación del aliento. Una persona enferma, o expuesta directamente a fuentes de calor, perderá mucho más líquido, por lo que sus necesidades de consumo también aumentarán.
Desinfección del agua potable
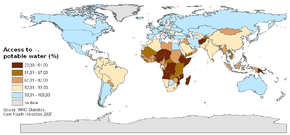
Población con acceso al agua potable en el mundo:
| Entre 22 y 51% Entre 51 y 71% Entre 67 y 82% | Entre 82 y 93% Entre 93 y 100% Sin datos |

Una niña con una botella de agua en África donde la diarrea es frecuente en los niños. La escasez de agua y la deficiente infraestructura causan más de 5 millones de muertes al año por consumo de agua contaminada. El agua de boca es uno de los principales transmisores de microorganismos causantes de enfermedades, principalmente bacterias, virus y protozoos intestinales. Las grandes epidemias de la humanidad han prosperado por la contaminación del agua de boca. Por referencias se conoce que se recomendaba hervir el agua desde quinientos años antes de nuestra era.[46]
Actualmente en los países desarrollados están prácticamente controlados los problemas que planteaban las aguas contaminadas. Los procesos de filtración y desinfección mediante cloro a los que se somete al agua antes del consumo humano se han impuesto en el siglo XX y se estima que son los causantes del 50% de aumento de la expectativa de vida de los países desarrollados en el siglo pasado. La cloración y filtración del agua fue considerada por la revista Life probablemente el más importante progreso de salud pública del milenio. El cloro es el material más usado como desinfectante del agua. La hipótesis más aceptada de cómo actúa y destruye el cloro estos microorganismos patógenos es que produce alteraciones físicas, químicas y bioquímicas en la membrana o pared protectora de las células ocasionando el fin de sus funciones vitales.[46]
El cloro puede resultar irritante para las mucosas y la piel por ello su utilización está estrictamente vigilada. La proporción usada varía entre 1ppm cuando se trata de purificar el agua para su consumo, y entre 1-2 ppm para la preparación de agua de baño. La aplicación inadecuada de componentes químicos en el agua puede resultar peligroso. La aplicación de cloro como desinfectante comenzó en 1912 en los Estados Unidos. Al año siguiente Wallace y Tiernan diseñaron unos equipos que podían medir el cloro gas y formar una solución concentrada que se añadía al agua a tratar. Desde entonces la técnica de cloración ha seguido progresando. Además de su capacidad destructora de gérmenes, su capacidad oxidante es muy grande y su acción también es muy beneficiosa en la eliminación del hierro, manganeso, sulfhídricos, sulfuros y otras sustancias reductoras del agua. Muchos países en sus normativas establecen desinfecciones mediante cloro y exigen el mantenimiento de una determinada concentración residual de desinfectante en sus redes de tuberías de distribución de agua. A veces se emplea cloraminas como desinfectante secundario para mantener durante más tiempo una determinada concentración de cloro en el sistema de abastecimiento de agua potable.[47]
Dificultades en el mundo para acceder al agua potable
El agua adecuada para el consumo humano se llama agua potable. Como se ha explicado el agua que no reúne las condiciones adecuadas para su consumo puede ser potabilizada mediante filtración o mediante otros procesos fisicoquímicos.
La población mundial ha pasado de 2.630 millones en 1950 a 6.671 millones en 2008. En este periodo (de 1950 a 2010) la población urbana ha pasado de 733 millones a 3.505 millones. Es en los asentamientos humanos donde se concentra el uso del agua no agrícola y donde se contraen la mayoría de las enfermedades relacionadas con el agua.[48]
Ante la dificultad de disponer de agua potable para consumo humano en muchos lugares del planeta, se ha consolidado un concepto intermedio, el agua segura como el agua que no contiene bacterias peligrosas, metales tóxicos disueltos, o productos químicos dañinos a la salud, y es por lo tanto considerada segura para beber, por tanto se emplea cuando el suministro de agua potable está comprometido. Es un agua que no resulta perjudicial para el ser humano, aunque no reúna las condiciones ideales para su consumo.
Por diversos motivos, la disponibilidad del agua resulta problemática en buena parte del mundo, y por ello se ha convertido en una de las principales preocupaciones de gobiernos en todo el mundo. Actualmente, se estima que alrededor de mil millones[49] de personas tienen un deficiente acceso al agua potable. Esta situación se agrava por el consumo de aguas en malas condiciones, que favorece la proliferación de enfermedades y brotes epidémicos. Muchos de los países reunidos en Evian en la XXIXª conferencia del G-8 se marcaron 2015 como fecha límite para conseguir el acceso universal a agua en mejores condiciones en todo el mundo.[50] Incluso si se lograse este difícil objetivo, se calcula que aún quedaría alrededor de 500 millones sin acceso al agua potable, y más de mil millones carecerían de un adecuado sistema de saneamiento. La mala calidad el agua y el saneamiento irregular afectan gravemente el estado sanitario de la población: sólo el consumo de agua contaminada causa 5.000.000 de muertes al año, según informes[51] de las Naciones Unidas, que declararon 2005-2015 la "Década de la acción". La OMS estima que la adopción de políticas de agua segura podría evitar la muerte de 1.400.000 niños al año, víctimas de diarrea.[52] [53] 50 países que reúnen a casi un tercio de la población mundial carecen de un adecuado suministro de agua,[54] y 17 de ellos extraen anualmente más agua de sus acuíferos de la que puede renovarse naturalmente.[55] La contaminación, por otra parte, no sólo contamina el agua de ríos y mares, sino los recursos hídricos subterráneos que sirven de abastecimiento del consumo humano.[56]
El uso doméstico del agua

Niña en Malí abasteciéndose para su consumo doméstico del agua del subsuelo mediante una bomba manual. Además de precisar los seres humanos el agua para su existencia precisan del agua para su propio aseo y la limpieza. Se ha estimado que los humanos consumen «directamente o indirectamente» alrededor de un 54% del agua dulce superficial disponible en el mundo. Este porcentaje se desglosa en:
- Un 20%, utilizado para mantener la fauna y la flora, para el transporte de bienes (barcos) y para la pesca, y
- el 34% restante, utilizado de la siguiente manera: El 70% en irrigación, un 20% en la industria y un 10% en las ciudades y los hogares.[57] [58]
El consumo humano representa un porcentaje reducido del volumen de agua consumido a diario en el mundo. Se estima que un habitante de un país desarrollado consume alrededor de 5 litros diarios en forma de alimentos y bebidas.[59] Estas cifras se elevan dramáticamente si consideramos el consumo industrial doméstico. Un cálculo[60] aproximado de consumo de agua por persona/día en un país desarrollado, considerando el consumo industrial doméstico arroja los siguientes datos:
Consumo aproximado de agua por persona/día| Actividad | Consumo de agua |
|---|
| Lavar la ropa | 60-100 litros |
|---|
| Limpiar la casa | 15-40 litros |
|---|
| Limpiar la vajilla a máquina | 18-50 litros |
|---|
| Limpiar la vajilla a mano | 100 litros |
|---|
| Cocinar | 6-8 litros |
|---|
| Darse una ducha | 35-70 litros |
|---|
| Bañarse | 200 litros |
|---|
| Lavarse los dientes | 30 litros |
|---|
| Lavarse los dientes (cerrando el grifo) | 1,5 litros |
|---|
| Lavarse las manos | 1,5 litros |
|---|
| Afeitarse | 40-75 litros |
|---|
| Afeitarse (cerrando el grifo) | 3 litros |
|---|
| Lavar el coche con manguera | 500 litros |
|---|
| Descargar la cisterna | 10-15 litros |
|---|
| Media descarga de cisterna | 6 litros |
|---|
| Regar un jardín pequeño | 75 litros |
|---|
| Riego de plantas domésticas | 15 litros |
|---|
| Beber | 1,5 litros |
|---|
Estos hábitos de consumo señalados y el aumento de la población en el último siglo ha causando a la vez un aumento en el consumo del agua. Ello ha provocado que las autoridades han debido realizar campañas por el buen uso del agua. Actualmente, la concienciación es una tarea de enorme importancia para garantizar el futuro del agua en el planeta, y como tal es objeto de constantes actividades tanto a nivel nacional como municipal.[61] Por otra parte, las enormes diferencias entre el consumo diario por persona en países desarrollados y países en vías de desarrollo[62] señalan que el modelo hídrico actual no es sólo ecológicamente inviable: también lo es desde el punto de vista humanitario,[63] por lo que numerosas ONGs se esfuerzan[64] por incluir el derecho al agua entre los Derechos humanos.[65] Durante el V Foro Mundial del agua, convocado el 16 de marzo de 2009 en Estambul (Turquía), Loic Fauchon (Presidente del Consejo Mundial del Agua) subrayó la importancia de la regulación del consumo en estos términos:
"La época del agua fácil ya terminó...desde hace 50 años las políticas del agua en todo el mundo consistieron en aportar siempre más agua. Tenemos que entrar en políticas de regulación de la demanda"[66] El agua en la agricultura
Artículo principal: Riego 
Riego mediante un Pivot en un campo de algodón. La mayor parte del agua se destina a la agricultura, y es utilizada para irrigar los cultivos. La relación directa entre recursos hídricos y producción de alimentos es crítica por tanto para una población humana en constante crecimiento.[67] La irrigación absorbe hasta el 90% de los recursos hídricos de algunos países en desarrollo.[68] La agricultura es un sistema de producción tan antiguo que se ha sabido adaptar a los diferentes regímenes hídricos de cada país: Así, en zonas donde se den abundantes precipitaciones suelen realizarse cultivos de regadío, mientras que en zonas más secas son comunes los cultivos de secano. Más recientemente, y en entornos más adversos, como el desierto se ha experimentado con nuevas formas de cultivo, centradas en minimizar el consumo de agua. En la actualidad una de las vertientes más activas de la investigación genética intenta optimizar las especies que el hombre usa como alimento. También se ha empezado a hablar de agricultura espacial[69] para referirse a los experimentos destinados a difundir la agricultura por otros planetas.
Actualmente la agricultura supone una importante presión sobre las masas naturales de agua, tanto en cantidad como en calidad. Así, el agua que precisan los regadíos supone una disminución de los caudales naturales de los ríos y un descenso de los niveles de las aguas subterráneas que ocasionan un efecto negativo en los ecosistemas acuáticos. Por ejemplo, en España se riegan 3,4 millones de hectáreas que supone el 7% de la superficie nacional y emplea el 80% de los recursos hídricos disponibles.[70]
También el uso de nitratos y pesticidas en las labores agrícolas suponen la principal contaminación difusa de las masas de agua tanto superficial como subterránea. La más significativa es la contaminación por nitratos que produce la eutrofización de las aguas. En España el consumo anual de fertilizantes se estima en 1.076.000 toneladas de nitrógeno, 576.000 toneladas de fósforo y 444.000 toneladas de potasio. La mayor parte de los abonos son absorbidos por los cultivos, el resto es un potencial contaminante de las aguas.[70]
El uso del agua en la industria
La industria precisa el agua para múltiples aplicaciones, para calentar y para enfriar, para producir vapor de agua o como disolvente, como materia prima o para limpiar. La mayor parte, después de su uso, se elimina devolviéndola nuevamente a la naturaleza. Estos vertidos, a veces se tratan, pero otras el agua residual industrial vuelve al ciclo del agua sin tratarla adecuadamente. La calidad del agua de muchos ríos del mundo se está deteriorando y está afectando negativamente al medio ambiente acuático por los vertidos industriales de metales pesados, sustancias químicas o materia orgánica.[71] También se puede producir una contaminación indirecta: residuos sólidos pueden llevar agua contaminada u otros líquidos, el lixiviado, que se acaban filtrando al terreno y contaminando acuíferos si los residuos no se aíslan adecuadamente.[72]
Los mayores consumidores de agua para la industria en el año 2000 fueron: EE.UU. 220,7 km³; China 162 km³; Federación Rusa 48,7 km³; India 35,2 km³; Alemania 32 km³; Canadá 31,6 km³ y Francia 29,8 km³. En los países de habla hispana, España 6,6 km³; México 4,3 km³; Chile 3,2 km³ y Argentina 2,8 km³.[73]
En algunos países desarrollados y sobre todo en Asia Oriental y en el África subsahariana, el consumo industrial de agua puede superar ampliamente al doméstico.[74]
El agua es utilizada para la generación de energía eléctrica. La hidroelectricidad es la que se obtiene a través de la energía hidráulica. La energía hidroeléctrica se produce cuando el agua embalsada previamente en una presa cae por gravedad en una central hidroeléctrica, haciendo girar en dicho proceso una turbina engranada a un alternador de energía eléctrica. Este tipo de energía es de bajo coste, no produce contaminación, y es renovable.
El agua es fundamental para varios procesos industriales y maquinarias, como la turbina de vapor, el intercambiador de calor, y también su uso como disolvente químico. El vertido de aguas residuales procedentes de procesos industriales causan varios tipos de contaminación como: la contaminación hídrica causada por descargas de solutos y la contaminación térmica causada por la descarga del refrigerante.
Otra de las aplicaciones industriales es el agua presurizada, la cual se emplea en equipos de hidrodemolición, en máquinas de corte con chorro de agua, y también se utiliza en pistolas de agua con alta presión para cortar de forma eficaz y precisa varios materiales como acero, hormigón, hormigón armado, cerámica, etc. El agua a presión también se usa para evitar el recalentamiento de maquinaria como las sierras eléctricas o entre elementos sometidos a un intenso rozamiento.
El agua como transmisor de calor
El agua y el vapor son usados como transmisores de calor en diversos sistemas de intercambio de calor, debido a su disponibilidad, por su elevada capacidad calorífica, y también por su facultad de enfriar y calentar. El vapor condensado es un calentador eficiente debido a su elevado calor de vaporización. Una desventaja del agua y el vapor es que en cierta manera son corrosivos. En la mayoría de centrales eléctricas, el agua es utilizada como refrigerante, la cual posteriormente se evapora y en las turbinas de vapor se genera energía mecánica, permitiendo el funcionamiento de los generadores que producen electricidad.
En la industria nuclear, el agua puede ser usada como moderador nuclear. En un reactor de agua a presión, el agua actúa como refrigerante y moderador. Esto aumenta la eficacia del sistema de seguridad pasivo de la central nuclear, ya que el agua ralentiza la reacción nuclear, manteniendo la reacción en cadena.
Procesamiento de alimentos
El agua desempeña un papel crucial en la tecnología de alimentos. El agua es básica en el procesamiento de alimentos y las características de ella influyen en la calidad de los alimentos.
Los solutos que se encuentran en el agua, tales como las sales y los azucares, afectan las propiedades físicas del agua y también alteran el punto de ebullición y de congelación del agua. Un mol de sacarosa (azúcar) aumenta el punto de ebullición del agua a 0.52 °C, y un mol de cloruro de sodio aumenta el punto de ebullición a 1.04 °C a la vez que disminuye del mismo modo el punto de congelamiento del agua.[75] Los solutos del agua también afectan la actividad de esta, y a su vez afectan muchas reacciones químicas y el crecimiento de microorganismos en los alimentos.[76] Se denomina actividad del agua a la relación que existe entre la presión de vapor de la solución y la presión de vapor de agua pura.[75] Los solutos en el agua disminuyen la actividad acuosa, y es importante conocer esta información debido a que la mayoría del crecimiento bacteriano cesa cuando existen niveles bajos de actividad acuosa.[76] El crecimiento de microbios no es el único factor que afecta la seguridad de los alimentos, también existen otros factores como son la preservación y el tiempo de expiración de los alimentos.
Otro factor crítico en el procesamiento de alimentos es la dureza del agua, ya que esta puede afectar drásticamente la calidad de un producto a la vez que ejerce un papel en las condiciones de salubridad. La dureza del agua mide la concentración de compuestos minerales que hay en una determinada cantidad de agua, especialmente carbonato de calcio y magnesio.[75] La dureza del agua se clasifica en:
La dureza del agua puede ser alterada o tratada mediante el uso de un sistema químico de intercambio iónico. El nivel de pH del agua se ve alterado por su dureza, jugando un papel crítico en el procesamiento de alimentos. Por ejemplo, el agua dura impide la producción eficaz de bebidas cristalinas. La dureza del agua también afecta la salubridad; de hecho, cuando la dureza aumenta, el agua pierde su efectividad desinfectante.[75]
Algunos métodos populares utilizados en la cocción de alimentos son: la ebullición, la cocción al vapor, y hervir a fuego lento. Estos procedimientos culinarios requieren la inmersión de los alimentos en el agua cuando esta se encuentra en su estado líquido o de vapor.
Aplicaciones químicas
Las reacciones orgánicas generalmente se tiemplan con agua o con una solución acuosa que puede estar compuesta por ácido, por una base o por un tampón químico. El agua es generalmente eficaz para eliminar sales inorgánicas. En las reacciones inorgánicas el agua es un solvente común, debido a que no disuelve los reactivos en su totalidad, también es anfótera (puede reaccionar en su estado ácido y base) y nucleófila. Sin embargo, estas propiedades a veces son deseadas. También se ha observado que el agua causa una aceleración en la reacción de Diels-Alder. Los fluidos supercríticos están siendo investigados en la actualidad, ya que el agua supercrítica (saturada en oxígeno) hace combustión en los contaminantes de manera eficiente.
El agua empleada como disolvente
El agua es descrita muchas veces como el solvente universal, porque disuelve muchos de los compuestos conocidos. Sin embargo no llega a disolver todos los compuestos.
En términos químicos, el agua es un solvente eficaz porque permite disolver iones y moléculas polares. La inmensa mayoría de las sustancias pueden ser disueltas en agua. Cuando el agua es empleada como solvente se obtiene una disolución acuosa; por lo tanto, a la sustancia disuelta se la denomina soluto y al medio que la dispersa se lo llama disolvente. En el proceso de disolución, las moléculas del agua se agrupan alrededor de los iones o moléculas de la sustancia para mantenerlas alejadas o dispersadas. Cuando un compuesto iónico se disuelve en agua, los extremos positivos (hidrógeno) de la molécula del agua son atraídos por los aniones que contienen iones con carga negativa, mientras que los extremos negativos (oxígeno) de la molécula son atraídos por los cationes que contienen iones con carga positiva.[77] Un ejemplo de disolución de un compuesto iónico en agua es el cloruro de sodio (sal de mesa), y un ejemplo de disolución de un compuesto molecular en agua es el azúcar.
Las propiedades del agua son esenciales para todos los seres vivientes, su capacidad como solvente le convierte en un componente necesario de los fluidos vitales como el citoplasma de la sangre, la savia de las plantas, entre otros.[78] De hecho, el citoplasma está compuesto en un 90% de agua, las células vivas tienen un 60 a 90% de agua, y las células inactivas de un 10% a un 20%.[79]
La solvatación o la suspensión se emplean a diario para el lavado tales como vestimenta, pisos, alimentos, mascotas, automóviles y el cuerpo humano. Los residuos humanos también son conducidos por el agua a las instalaciones de tratamiento de aguas residuales. El uso del agua como solvente de limpieza consume una gran cantidad de agua en los países industrializados.
El agua facilita el procesamiento biológico y químico de las aguas residuales. El ambiente acuoso ayuda a descomponer los contaminantes, debido a su capacidad de volverse una solución homogénea, que puede ser tratada de manera flexible. Los microorganismos que viven en el agua pueden acceder a los residuos disueltos y pueden alimentarse de ellos, descomponiéndoles en sustancias menos contaminantes. Para ello los tratamientos aeróbicos se utilizan de forma generalizada añadiendo oxígeno o aire a la solución, incrementando la velocidad de descomposición y reduciendo la reactividad de las sustancias nocivas que lo componen. Otros ejemplos de sistemas biológicos para el tratamiento de las aguas residuales son los cañaverales y los biodigestores anaeróbicos. Por lo general en los tratamientos químicos y biológicos de los desperdicios, quedan residuos sólidos del proceso de tratamiento. Dependiendo de su composición, el residuo restante puede ser secado y utilizado como fertilizante si sus propiedades son beneficiosas, o puede ser desechado en un vertedero o incinerado.
Otros usos
El agua como extintor de fuego
El agua posee un elevado calor latente de vaporización y es relativamente inerte, convirtiéndole en un fluido eficaz para apagar incendios. El calor del fuego es absorbido por el agua para luego evaporarse, extinguiendo por enfriamiento. Sin embargo, el agua no debe ser utilizada para apagar el fuego de equipos eléctricos, debido a que el agua impura es un buen conductor de electricidad. Asimismo, no debe ser empleada para extinguir combustibles líquidos o solventes orgánicos puesto que flotan en el agua y la ebullición explosiva del agua tiende a extender el fuego.
Cuando se utiliza el agua para apagar incendios se debe considerar el riesgo de una explosión de vapor, ya que puede ocurrir cuando se la utiliza en espacios reducidos y en fuegos sobrecalentados. También se debe tomar en cuenta el peligro de una explosión de hidrógeno, que ocurre cuando ciertas sustancias, como metales o el grafito caliente, se descomponen en el agua produciendo hidrógeno.
El accidente de Chernóbil es un claro ejemplo de la potencia de este tipo de explosiones, aunque en este caso el agua no provino de los esfuerzos por combatir el fuego sino del propio sistema de enfriamiento del reactor, ocasionando una explosión de vapor causada por el sobrecalentamiento del núcleo del reactor. También existe la posibilidad de que pudo haber ocurrido una explosión de hidrógeno causada por la reacción química entre el vapor y el circonio caliente.
Deportes y diversión
Los humanos utilizan el agua para varios propósitos recreativos, entre los cuales se encuentran la ejercitación y la práctica de deportes. Algunos de estos deportes incluyen la natación, el esquí acuático, la navegación, el surf y el salto. Existen además otros deportes que se practican sobre una superficie de hielo como el hockey sobre hielo, y el patinaje sobre hielo.
Las riberas de los lagos, las playas, y los parques acuáticos son lugares populares de relajación y diversión. Algunas personas consideran que el sonido del flujo del agua tiene un efecto tranquilizante. Otros personas tienen acuarios o estanques con peces y vida marina por diversión, compañía, o para exhibirlos. Los humanos también practican deportes de nieve como el esquí o el snowboarding. También se utiliza para juegos de pelea mediante el lanzamiento de bolas de nieve, globos de agua, e inclusive con el uso de pistolas de agua. Otra de las aplicaciones del agua es para decorar lugares públicos o privados con la construcción de fuentes o surtidores de agua.
Como estándar científico
El 7 de abril de 1795, el gramo fue definido en Francia como "el peso absoluto de un volumen de agua pura igual a un cubo de la centésima parte de un metro, a la temperatura de fusión del hielo".[80] Por motivos prácticos, se popularizó una medida mil veces mayor de referencia para los metales. El trabajo encargado era por tanto calcular con precisión la masa de un litro de agua. A pesar del hecho de que la propia definición de gramo especificaba los 0º C —una punto de temperatura muy estable— los científicos prefirieron redefinir el estándar y realizar sus mediciones en función de la densidad más estable, es decir, alrededor de los 4 °C.[81]
La escala de temperaturas Kelvin del SI se basa en el punto triple del agua, definido exactamente como 273.16º K (0.01º C). La escala Kelvin es una evolución más desarrollada de la Celsius, que está definida tan sólo por el punto de ebullición (=100º C) y el punto de fusión (=0º C) del agua. El agua natural se compone principalmente de isótopos hidrógeno-1 y oxígeno-16, pero hay también una pequeña cantidad de isótopos más pesados como hidrógeno-2 (deuterio). La cantidad de óxidos de deuterio del agua pesada es también muy reducida, pero afecta enormemente a las propiedades del agua. El agua de ríos y lagos suele tener menos deuterio que el agua del mar. Por ello, se definió un estándar de agua según su contenido en deuterio: El VSMOV, o Estándar de Viena Agua del Océano Promedio.
La contaminación y la depuración del agua

Contaminación en un río de Brasil. Los humanos llevamos mucho tiempo depositando nuestros residuos y basuras en la atmósfera, en la tierra y en el agua. Esta forma de actuar hace que los residuos no se traten adecuadamente y causen contaminación. La contaminación del agua afecta a las precipitaciones, a las aguas superficiales, a las subterráneas y como consecuencia degrada los ecosistemas naturales.[82]
El crecimiento de la población y la expansión de sus actividades económicas están presionando negativamente a los ecosistemas de las aguas costeras, los ríos, los lagos, los humedales y los acuíferos. Ejemplos son la construcción a lo largo de la costa de nuevos puertos y zonas urbanas, la alteración de los sistemas fluviales para la navegación y para embalses de almacenamiento de agua, el drenaje de humedales para aumentar la superficie agrícola, la sobreexplotación de los fondos pesqueros, las múltiples fuentes de contaminación provenientes de la agricultura, la industria, el turismo y las aguas residuales de los hogares. Un dato significativo de esta presión es que mientras la población desde 1900 se ha multiplicado por cuatro, la extracción de agua se ha multiplicado por seis. La calidad de las masas naturales de agua se está reduciendo debido al aumento de la contaminación y a los factores mencionados.[83]
La Asamblea General de la ONU estableció en el año 2000 ocho objetivos para el futuro (Objetivos de Desarrollo del Milenio). Entre ellos estaba el que los países se esforzasen en invertir la tendencia de pérdida de recursos medioambientales, pues se reconocía la necesidad de preservar los ecosistemas, esenciales para mantener la biodiversidad y el bienestar humano, pues de ellos depende la obtención de agua potable y alimentos.[84]
Para ello además de políticas de desarrollo sostenible, se precisan sistemas de depuración que mejoren la calidad de los vertidos generados por la actividad humana. La depuración del agua es el conjunto de tratamientos de tipo físico, químico o biológico que mejoran la calidad de las aguas o que eliminan o reducen la contaminación. Hay dos tipos de tratamientos: los que se aplican para obtener agua de calidad apta para el consumo humano y los que reducen la contaminación del agua en los vertidos a la naturaleza después de su uso.
La depuración del agua para beber
El agua destinada al consumo humano es la que sirve para beber, cocinar, preparar alimentos u otros usos domésticos. Cada país regula por ley la calidad del agua destinada al consumo humano. La ley europea protege la salud de las personas de los efectos adversos derivados de cualquier tipo de contaminación de las aguas destinadas al consumo humano garantizando su salubridad y limpieza y por ello no puede contener ningún tipo de microorganismo, parásito o sustancia, en una cantidad o concentración que pueda suponer un peligro para la salud humana. Así debe estar totalmente exenta de las bacterias escherichia coli y enterococcus, limita por litro de agua tener menos de 50 miligramos de nitratos, menos de 2 miligramos de cobre y otras sustancias químicas.[85]
Habitualmente el agua potable es captada de manantiales, o extraída del suelo mediante túneles artificiales o pozos de un acuífero. Otras fuentes de agua son el agua lluvia, los ríos y los lagos. No obstante, el agua debe ser tratada para el consumo humano, y puede ser necesaria la extracción de sustancias disueltas, de sustancias sin disolver y de microorganismos perjudiciales para la salud. Existen diferentes tecnologías para potabilizar el agua. Habitualmente incluyen diversos procesos donde toda el agua que se trata puede pasar por tratamientos de filtración, coagulación, floculación o decantación. Uno de los métodos populares es a través de la filtración del agua con arena, en donde únicamente se eliminan las sustancias sin disolver. Por otro lado mediante la cloración se logra eliminar microbios peligrosos. Existen técnicas más avanzadas de purificación del agua como la ósmosis inversa. También existe el método de desalinización, un proceso por el cual se retira la sal del agua de mar; sin embargo, es costoso[86] por el elevado gasto de energía eléctrica y suele emplearse con más frecuencia en las zonas costeras con clima árido.
La distribución del agua potable se realiza a través de la red de abastecimiento de agua potable por tuberías subterráneas o mediante el agua embotellada.
En algunas ciudades donde escasea, como Hong Kong, el agua de mar es usada ampliamente en los inodoros con el propósito de conservar el agua potable.[87]
La depuración del agua residual
El tratamiento de aguas residuales se emplea en los residuos urbanos generados en la actividad humana y en los residuos provenientes de la industria.
El agua residual, también llamada negra o fecal, es la que usada por el hombre ha quedado contaminada. Lleva en suspensión una combinación de heces fecales y orina, de las aguas procedentes del lavado con detergentes del cuerpo humano, de su vestimenta y de la limpieza, de desperdicios de cocina y domésticos, etc. También recibe ese nombre los residuos generados en la industria. En la depuración se realizan una serie de tratamientos en cadena. El primero denominado pretratamiento separa los sólidos gruesos mediante rejas, desarenadores o separadores de grasas. Después un tratamiento denominado primario separa mediante una sedimentación física los sólidos orgánicos e inorgánicos sedimentables.
Necesidad de políticas proteccionistas
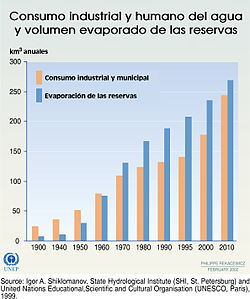
Tendencias del consumo y la evaporación de acuíferos durante el último siglo. 
Aproximación de la proporción de personas en los países en desarrollo con acceso a agua potable desde 1970 al 2000. La política del agua es la política diseñada para asignar, distribuir y administrar los recursos hídricos y el agua.[88] La disponibilidad de agua potable per cápita ha ido disminuyendo debido a varios factores como la contaminación, la sobrepoblación, el riego excesivo, el mal uso[89] y el creciente ritmo de consumo.[90] Por esta razón, el agua es un recurso estratégico para el mundo y un importante factor en muchos conflictos contemporáneos.[91] Indudablemente, la escasez de agua tiene un impacto en la salud[92] y la biodiversidad.[93]
Desde 1990, 1.6 mil millones de personas tienen acceso a una fuente de agua potable.[1] Se ha calculado que la proporción de gente en los países desarrollados con acceso a agua segura ha mejorado del 30% en 1970[7] al 71% en 1990, y del 79% en el 2000 al 84% en el 2004. Se pronostica que esta tendencia seguirá en la misma dirección los próximos años.[8] Uno de los Objetivos de Desarrollo del Milenio (ODM) de los países miembros de las Naciones Unidas es reducir al 50% la proporción de personas sin acceso sostenible a fuentes de agua potable y se estima que la meta será alcanzada en el 2015.[94] La ONU pronostica que el gasto necesario para cumplir dicho objetivo será de aproximadamente 50 a 102 mil millones de dólares.[95]
Según un reporte de las Naciones Unidas del año 2006, «a nivel mundial existe suficiente agua para todos», pero el acceso ha sido obstaculizado por la corrupción y la mala administración.[96]
En el Informe de la Unesco sobre el Desarrollo de los Recursos Hídricos en el Mundo (WWDR, 2003) de su Programa Mundial de Evaluación de los Recursos Hídricos (WWAP) predice que en los próximos veinte años la cantidad de agua disponible para todos disminuirá al 30%; en efecto, el 40% de la población mundial tiene insuficiente agua potable para la higiene básica. Más de 2.2 millones de personas murieron en el año 2000 a consecuencia de enfermedades transmitidas por el agua (relacionadas con el consumo de agua contaminada) o sequías. En el 2004 la organización sin ánimo de lucro WaterAid, informó que cada 15 segundos un niño muere a causa de enfermedades relacionadas con el agua que pueden ser prevenidas[97] y que usualmente se deben a la falta de un sistema de tratamiento de aguas residuales.
Estas son algunas de las organizaciones que respaldan la protección del agua: International Water Association (IWA), WaterAid, Water 1st, y American Water Resources Association. También existen varios convenios internacionales relacionados con el agua como: la Convención de las Naciones Unidas de Lucha contra la Desertificación (CNULD), el Convenio Internacional para prevenir la contaminación por los Buques, la Convención de las Naciones Unidas sobre el Derecho del mar, y el Convenio de Ramsar. El Día Mundial del Agua se celebra el 22 de marzo[98] y el Día Mundial del Océano se celebra el 8 de junio.
Religión, filosofía y literatura
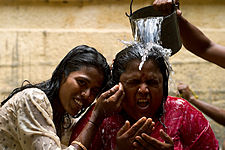
Ceremonia hinduista de purificación con agua en el estado de Tamil Nadu, India. El agua es considerada como un elemento purificador en la mayoría de religiones. Algunas de las doctrinas religiosas que incorporan el ritual de lavado o abluciones son: el cristianismo, el hinduismo, el movimiento rastafari, el islam, el sintoísmo, el taoísmo y el judaísmo. Uno de los sacramentos centrales del cristianismo es el bautismo y el cual se realiza mediante la inmersión, aspersión o afusión de una persona en el agua. Dicha práctica también se ejecuta en otras religiones como el judaísmo donde es denominada mikve y en el sijismo donde toma el nombre de Amrit Sanskar. Asimismo, en muchas religiones incluyendo el judaísmo y el islam se realizan baños rituales de purificación a los muertos en el agua. Según el islam, las cinco oraciones al día (o salat) deben llevarse a cabo después de haber lavado ciertas partes del cuerpo usando agua limpia o abdesto; sin embargo, en caso de que no hubiese agua limpia se realizan abluciones con polvo o arena las cuales son denominadas tayammum. En el sintoísmo el agua es empleada en casi todos los rituales para purificar una persona o un lugar, como es el caso del ritual misogi. El agua es mencionada 442 veces en la Nueva Versión Internacional de la Biblia y 363 veces en la Biblia del rey Jacobo: Pedro 2:3-5 establece, «Estos ignoran voluntariamente que en el tiempo antiguo fueron hechos por la palabra de Dios los cielos y también la tierra, que proviene del agua y por el agua subsiste».[99]
Algunos cultos emplean agua especialmente preparada para propósitos religiosos, como el agua bendita de algunas denominaciones cristianas o el amrita en el sijismo y el hinduismo. Muchas religiones también consideran que algunas fuentes o cuerpos de agua son sagrados o por lo menos favorecedores; y algunos ejemplos incluyen: la ciudad de Lourdes de acuerdo con el catolicismo, el río Jordán (al menos simbólicamente) en algunas iglesias cristianas, el pozo de Zamzam en el islam, y el río Ganges en el hinduismo y otros cultos de la región. Muchos etnólogos, como Frazer, han subrayado el papel purificador del agua.[100]
Usualmente se cree que el agua tiene poderes espirituales. En la mitología celta, Sulis es la diosa de las aguas termales; en el hinduismo, el Ganges es personificado por una diosa, y según los textos Vedas la diosa hindú Sárasuati representa al río del mismo nombre. El agua es también en el vishnuísmo uno de los cinco elementos básicos o mahābhūta, entre los que constan: el fuego, la tierra, el espacio y el aire. Alternativamente, los dioses pueden ser considerados patrones de fuentes, ríos o lagos. De hecho, en la mitología griega y romana, Peneo era el dios río, uno de los tres mil ríos o a veces incluido entre las tres mil Oceánidas. En el islam el agua no es sólo la fuente de vida, pero cada vida está compuesta de agua: «¿Y que sacamos del agua a todo ser viviente?».[101] [102]
En cuanto a la filosofía, podemos encontrar a Tales de Mileto, uno de los siete sabios griegos, que afirmó que el agua era la sustancia última, el Arjé, del cosmos, de donde todo está conformado por el agua. Empédocles, un filósofo de la antigua Grecia, sostenía la hipótesis de que el agua es uno de los cuatro elementos clásicos junto al fuego, la tierra y el aire, y era considerada la sustancia básica del universo o ylem. Según la teoría de los cuatro humores, el agua está relacionada con la flema. En la filosofía tradicional china el agua es uno de los cinco elementos junto a la tierra, el fuego, la madera, y el metal.
El agua también desempeña un papel importante en la literatura como símbolo de purificación. Algunos ejemplos incluyen a un río como el eje central donde se desarrollan las principales acciones, como es el caso de la novela Mientras agonizo de William Faulkner y el ahogamiento de Ofelia en Hamlet.
Véase también
Referencias
- ↑ Kofi A. Annan, op. cit., prefacio V
- ↑ «CIA- The world face book». Central Intelligence Agency. Consultado el 20 de diciembre de 2008.
- ↑ a b c «Earth's water distribution». U.S. Geological Survey. Consultado el 17 de mayo 2007.
- ↑ «WORLD WATER RESOURCES AT THE BEGINNING OF THE 21ST CENTURY». Unesco. Consultado el 30/04/2009.
- ↑ Baroni, L.; Cenci, L.; Tettamanti, M.; Berati, M. (2007) «Evaluating the environmental impact of various dietary patterns combined with different food production systems» European Journal of Clinical Nutrition. Vol. 61. pp. 279–286. DOI 10.1038/sj.ejcn.1602522.
- ↑ a b «No hay crisis mundial de agua, pero muchos países en vías de desarrollo tendrán que hacer frente a la escasez de recursos hídricos». Fao. Consultado el 30/04/2009.
- ↑ a b Björn Lomborg (2001), The Skeptical Environmentalist (Cambridge University Press), ISBN 0-521-01068-3, p. 22
- ↑ a b MDG Report 2008
- ↑ Davie (2003), pág.2
- ↑ Datos del Centro del Agua del Trópico Húmedo para la América Latina y el Caribe (CATHALAC), en Tipos de agua, del portal agua.org.mx.
- ↑ Braun, Charles L.; Sergei N. Smirnov (1993) «Why is water blue?» J. Chem. Educ.. Vol. 70. n.º 8. pp. 612.
- ↑ Véanse las tablas elaboradas por un equipo de la Escuela de Ingeniería de Antioquía (Colombia).
- ↑ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 0-13-250882-6.
- ↑ La demostración visual de este fenómeno, en www.youtube.com
- ↑ Water en Wolfram|Alpha (Consultado el 27 de mayo de 2009).
- ↑ Véase este vídeo, que intenta probar la posibilidad de obtener energía del agua. En realidad, la energía invertida en el proceso es mucho mayor que la obtenida tras el mismo.
- ↑ Ball, Philip (14 de septiembre de 2007). «Burning water and other myths». Nature News. Consultado el 14 de septiembre de 2007.
- ↑ Así, el célebre y dudoso estudio de Jacques Benveniste probando la capacidad mnemotécnica del agua. Véase este enlace para más información.
- ↑ Entrevista en The Independent, 23 de mayo de 1995. Consultado el 22 de abril de 2009.
- ↑ Gary Melnick, Harvard-Smithsonian Center for Astrophysics y David Neufeld, Johns Hopkins University. citados en: «Discover of Water Vapor Near Orion Nebula Suggests Possible Origin of H20 in Solar System (sic)», The Harvard University Gazette, 23 de abril de 1998. «"El descubrimiento de vapor de agua cerca de Nébula Orión sugiere un posible origen del H20 en el Sistema Solar" (en inglés). Space Cloud Holds Enough Water to Fill Earth's Oceans 1 Million Times», Headlines@Hopkins, JHU, 9 de abril de 1998. «Water, Water Everywhere: Radio telescope finds water is common in universe», The Harvard University Gazette, 25 de febrero de 1999.(linked 4/2007)
- ↑ Concretamente, el hidrógeno y el oxígeno ocupan el primer y tercer lugar, respectivamente, en el ranking de elementos químicos en el universo conocido. Datos según este informe, (formato pdf)
- ↑ «MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere». Planetary Society (3 de julio de 2008). Consultado el 5 de julio de 2008.
- ↑ Hallada agua en un planeta distante (en inglés) 12 de julio de 2007, por Laura Blue, Time
- ↑ Descubren un planeta con agua fuera del sistema solar, en El Mundo (edición digital del 17 de julio de 2007. Consultado el 26 de abril de 2009.
- ↑ Encuentran agua en la atmósfera de un exoplaneta - Space.com (en inglés).
- ↑ Versteckt in Glasperlen: Auf dem Mond gibt es Wasser - Wissenschaft - SPIEGEL ONLINE - Nachrichten
- ↑ J. C. I. Dooge. "Integrated Management of Water Resources", en E. Ehlers, T. Krafft. (eds.) Understanding the Earth System: compartments, processes, and interactions. Springer, 2001, p. 116. Más referencias al final del artículo "Habitable Zone" en The Encyclopedia of Astrobiology, Astronomy and Spaceflight.
- ↑ Error en la cita: El elemento
<ref> no es válido; pues no hay una referencia con texto llamada inu1 - ↑ Una cuarta parte del planeta ya está amenazada por la desertificación en 20 minutos, 18 de junio de 2009.
- ↑ La desertización avanza en España y afecta ya a más del 30% del territorio, El País, 16/6/2006. Consultado el 20/4/2009
- ↑ Página oficial del "Día contra la desertización", en www.un.org
- ↑ a b c d 2º Informe de Naciones Unidas sobre Desarrollo Recursos Hídricos en el Mundo, p.123-9
- ↑ La contaminación del lago Baikal es inferior a la estimada, en Masmar.net, 5 de septiembre de 2008. Consultado el 26 de abril de 2009.
- ↑ Descubren bacterias que viven sin luz ni oxígeno bajo el hielo de la Antártida, El Mundo, 20-04-2009.
- ↑ Concretamente, en los sistemas hidrotermales marinos profundos. Véase MAHER, Kevin A., y STEPHENSON, David J., "Impact frustration of the origin of life", Nature, Vol. 331, pp. 612–614. 18 de febrero de 1988.
- ↑ "El país que no tiene agua o que tiene dificultades con el agua está condenado al subdesarrollo, salvo que tenga petróleo o algún otro recurso en cantidades ingentes", Alberto Crespo, en "La crisis del agua refleja otras crisis". BBC.com, 14 de marzo de 2006. Consultado el 27 de abril de 2009.
- ↑ ¿Qué porcentaje del cuerpo es agua? Jeffrey Utz, M.D., The MadSci Network
- ↑ «Healthy Water Living». Consultado el 1 de febrero de 2007.
- ↑ Rhoades RA, Tanner GA (2003). Medical Physiology, 2nd ed. edición, Baltimore: Lippincott Williams & Wilkins. OCLC 50554808. ISBN 0781719364.
- ↑ "Bebe al menos ocho vasos de agua al día." ¿De veras? ¿Hay algún indicio científico para el "8 × 8"?, por Heinz Valdin, Departmento de Fisiología, Dartmouth Medical School, Lebanon, New Hampshire
- ↑ Por ejemplo, la relación entre el consumo de agua, la pérdida de peso y el estreñimiento.
- ↑ Drinking Water - How Much?, Factsmart.org web site and references within
- ↑ Food and Nutrition Board, National Academy of Sciences. Recommended Dietary Allowances, revised 1945. National Research Council, Reprint and Circular Series, No. 122, 1945 (agosto), p. 3–18.
- ↑ Dietary Reference Intakes: Water, Potassium, Sodium, Chloride, and Sulfate, Food and Nutrition Board
- ↑ Agua:¿Cuánta hay que beber cada día? - MayoClinic.com
- ↑ a b Rámirez Quirós, op. cit., p.8-20
- ↑ Rámirez Quirós, op. cit., p.21-23
- ↑ 2º Informe de Naciones Unidas sobre Desarrollo Recursos Hídricos en el Mundo, p.88-90
- ↑ Según este informe de la ONU, publicado en BBC.com el 26 de agosto de 2004. Consultado el 24 de abril de 2009.
- ↑ El "plan de acción" decidido en la Cumbre de Evian de 2003
- ↑ Día Mundial del Agua: 2.400 millones de personas la beben contaminada, 22 de abril de 2005. Consultado el 24 de abril de 2009.
- ↑ World Health Organization. Safe Water and Global Health.
- ↑ En otras estimaciones, unos 4.000 niños cada día.
- ↑ La ONU analizará la contaminación del agua con arsénico en China y en otros países de Asia, 18 de noviembre de 2004. Consultado el 26 de abril de 2009.
- ↑ Ravindranath, Nijavalli H.; Jayant A. Sathaye (2002). Climate Change and Developing Countries. Springer. OCLC 231965991. ISBN 1402001045.
- ↑ Problemas asociados con la contaminación del agua subterránea, en www.purdue.edu. Consultado el 26 de abril de 2009.
- ↑ Miller (2005), pág.173
- ↑ University of Michigan (4 de enero). «Human Appropriation of the World's Fresh Water Supply» (en inglés). University of Michigan. Consultado el 29 de abril de 2009.
- ↑ Datos extraídos del "libro Azul" del agua, editado por la compañía de aguas de bélgica. (en neerlandés).
- ↑ Los datos son de Intermon Oxfam, elaboración propia.
- ↑ Véanse las observaciones de GARCÍA NART, Marta; "El segundo catálogo español de Buenas Prácticas: reflexiones sobre el proceso, lecciones aprendidas y asignaturas pendientes", Ed. Instituto Juan de Herrera, Madrid, 1999, ISSN: 1578-097X.
- ↑ NORTEAMÉRICA: 333-666 litros/día, EUROPA: 158 litros/día, ASIA: 64 litros/día, ÁFRICA 15-50 litros/día, ESPAÑA: 147 litros/día. (Datos de Intermon Oxfam, incluyen consumo industrial).
- ↑ El hidrólogo sueco Malin Falkenmark formuló el término presión hídrica, para definir los países en los que el suministro de agua disponible por persona no alcanza los 1700 litros. Para saber más sobre presión hídrica y sostenibilidad, véase "Escasez de agua", publicado en Population Information Program, Center for Communication Programs, Volumen XXVIII, nº3, Otoño de 2000, Serie M, #15, Ed. por la Universidad Johns Hopkins para la Salud Pública, Baltimore, Maryland, USA.
- ↑ Por ejemplo, esta declaración de Amnistía Internacional del 24 de marzo de 2003. Consultado el 30 de abril de 2009.
- ↑ La cuestión ya fue planteada por un comité de expertos durante la celebración del IIIer Foro Mundial del Agua, en marzo de 2006.
- ↑ Yahoo noticias, 16 de marzo de 2009. Consultado el 30 de abril de 2009.
- ↑ Crisis del agua=Crisis Alimentaria, artículo de La Crónica de Hoy, 8 de junio de 2008. Consultado el 22 de abril de 2009
- ↑ WBCSD Water Faacts & Trends
- ↑ Animación sobre cultivos espaciales (requiere Flash).
- ↑ a b Gómez Limón, op. cit., p.56-59
- ↑ 2º Informe de Naciones Unidas sobre Desarrollo Recursos Hídricos en el Mundo, p.277
- ↑ 2º Informe de Naciones Unidas sobre Desarrollo Recursos Hídricos en el Mundo, p.281
- ↑ 2º Informe de Naciones Unidas sobre Desarrollo Recursos Hídricos en el Mundo, p. 300-302
- ↑ Véanse las tablas finales en el informe de Yurina OTAKI, Masahiro OTAKI y Tomoko YAMADA, “Attempt to Establish an Industrial Water Consumption Distribution Model”, Journal of Water and Environment Technology, Vol. 6, No. 2, pp.85-91, 2008. (en inglés)
- ↑ a b c d Vaclacik and Christian, 2003
- ↑ a b DeMan, 1999
- ↑ American Chemical Society (2006), pág.60
- ↑ Starr (2003), pág.29
- ↑ Rastogi (1996), pág.181
- ↑ Decreto sobre los pesos y las medidas
- ↑ here L'Histoire Du Mètre, La Détermination De L'Unité De Poids
- ↑ 2º Informe de Naciones Unidas sobre Desarrollo Recursos Hídricos en el Mundo, p.137
- ↑ 2º Informe de Naciones Unidas sobre Desarrollo Recursos Hídricos en el Mundo, p.161
- ↑ 2º Informe de Naciones Unidas sobre Desarrollo Recursos Hídricos en el Mundo, p.31
- ↑ «DIRECTIVA 98/83/CE relativa a la calidad de las aguas destinadas al consumo humano». Generalitat de Catalunya. Consultado el 10/05/2009.
- ↑ Costes económicos y medioambetales de la desalación de agua de mar, por el dr. Manuel Latorre, IV Congreso Ibérico de Gestión y Planificación del agua, 2004. Consultado el 27 de abril de 2009.
- ↑ Abastecimiento de agua en Hong Kong, en Arqhys.com. Consultado el 26 de abril de 2009.
- ↑ Park (2007), pág.219
- ↑ Swain (2004), pág.4
- ↑ Tendencias en el consumo humano e industrial de agua, y su relación el ritmo de la evaporación de las reservas. Estudio de Igor A. Shiklomanov, Instituto Hidrológico Estatal (SHI, San Petersburgo) y Unesco, París, 1999. 1999.
- ↑ Sobre la relación entre agua y guerra, véase La improbable guerra del agua, entrevista al geógrafo estadounidense Aaron Wolf, informe de la Unesco, octubre de 2001.
- ↑ Millones de enfermos por la falta de agua limpia en Pakistán, en Public Radio International (en inglés). Consultado el 26 de abril de 2009.
- ↑ Biodiversidad: Está en el agua, artículo que expone la relación entre precipitaciones, corrientes de agua y biodiversidad. En www.sciencedaily.com, consultado el 27 de abril de 2009.
- ↑ Reunión de Alto Nivel, Naciones Unidas (25 de septiembre). «Los Objetivos de Desarrollo del Milenio» (en español) págs. 2. Naciones Unidas. Consultado el 21 de abril de 2009.
- ↑ Herfkens, Eveline. «Washing away poverty» (en inglés). Consultado el 29 de abril de 2009.
- ↑ UNESCO. (2006). Water, a shared responsibility. The United Nations World Water Development Report 2.
- ↑ En www.midcoastwater.com.au, referencia original aquí. Consultado el 26 de abril de 2009.
- ↑ Bajo señales sombrías, en México IV Foro Mundial del agua, Agencia Federal de Noticias (DERF), 15 de marzo de 2006. Consultado el 22 de abril de 2009
- ↑ Pedro 2:3-5
- ↑ "En un lugar de Nueva Zelandia (sic), cuando se sentía la necesidad de una expiación de los pecados, se celebraba una ceremonia en la cual se transferían todos los pecados de la tribu a un individuo; un tallo de helecho previamente atado a una persona se sumergía con él en el río, se desataba allí y se le dejaba ir flotando hacia el mar, llevándose los pecados." FRAZER, J.G., La rama dorada: magia y religión, Fondo de Cultura Económica, 1994, México, pág. 613.
- ↑ Azora de Al-Anbiya 21:30
- ↑ Cortés, pág.307
Bibliografía
Bibliografía utilizada
- AMERICAN CHEMICAL SOCIETY (2006). Chemistry in the community. Nueva York: W.H. Freeman. ISBN 9780716789192.
- CORTÉS, Julio (1986). El Corán. Perseus Distribution. ISBN 0940368714.
- DAVIE, TIM (2003). «I- Hidrology as a Science», Fundamentals of Hydrology. Londres: Routledge. ISBN 0415220289.
- MILLER, Tyler (2005). «IX- Water resources and water pollution», Sustaining the earth. Thomson, Brooks & Cole. ISBN 0-534-49672-5.
- PARK, Chris (2007). A dictionary of environment and conservation. Oxford: Oxford University Press. ISBN 0198609957.
- RÁMIREZ QUIRÓS, Francisco (2005). Tratamiento de Desinfección del Agua Potable. Canal Isabel II. ISBN 84-933694-3-8.
- RASTOGI, S.C. (1996). Cell and molecular biology. New Age International. ISBN 8122412882.
- STARR, Cecie. Mary Arbogast (ed.). Biology: Concepts and applications, Fifth edition edición, Belmont: Wadsworth - Thomson Learning. ISBN 0-534-38549-4.
- SWAIN, Ashok (2004). «I-Water Scarcity», Managing water conflict. Nueva York: Routledge. ISBN 071465566X.
- TAUTSCHER, Carl (1991). «8.4», Contamination Effects on Electronic Products: Water. Nueva York: M. Dekker. ISBN 0824784235.
Bibliografía adicional (no utilizada directamente en este artículo)
- John M. DeMan (1999). Principles of Food Chemistry 3rd Edition.
- Vickie A. Vaclavik and Elizabeth W. Christian (2003). Essentials of Food Science 2nd Edition.
- OA Jones, JN Lester and N Voulvoulis, Pharmaceuticals: a threat to drinking water? TRENDS in Biotechnology 23(4): 163, 2005
- Franks, F (Ed), Water, A comprehensive treatise, Plenum Press, New York, 1972–1982
- PH Gleick and associates, The World's Water: The Biennial Report on Freshwater Resources. Island Press, Washington, D.C. (published every two years, beginning in 1998.)
- Marks, William E., The Holy Order of Water: Healing Earth's Waters and Ourselves. Bell Pond Books ( a div. of Steiner Books), Great Barrington, MA, November 2001 [ISBN 0-88010-483-X]
- DEBENEDETTI, P. G., y STANLEY, H. E.; "Supercooled and Glassy Water", Physics Today 56 (6), p. 40–46 (2003). Downloadable PDF (1.9 MB)
- Water SA
- IRWING, J.J. y SOICHET, B.K., "ZINC: A free database of commercially available compounds for virtual screening", en el Journal of Chemical Information and modeling 45, nº 1, 2005, págs. 177-182.
- POLING, B.E., PRAUSNITZ, J.M. y REID, R.C., The properties of gases and liquids (4ª edición), McGraw-Hill, 1987.
- PRAUSNITZ, J.M. REID, R.C. y SHERWOOD, T.K, The properties of gases and liquids (3ª edición), McGraw-Hill, 1977.
- REKLAITIS, G.V., Introduction to material and energy balances, John Wiley and Sons, Inc., 1983.
El agua como recurso natural
- Gleick, Peter H.. The World's Water: The Biennial Report on Freshwater Resources. Washington: Island Press. (10 de noviembre de 2006)| ISBN 978-1-59726-105-0]
- Postel, Sandra (1997, second edition). Last Oasis: Facing Water Scarcity. New York: Norton Press.
- Anderson (1991). Water Rights: Scarce Resource Allocation, Bureaucracy, and the Environment.
- Marq de Villiers (2003, revised edition). Water: The Fate of Our Most Precious Resource.
- Diane Raines Ward (2002). Water Wars: Drought, Flood, Folly and the Politics of Thirst.
- Miriam R. Lowi (1995). Water and Power: The Politics of a Scarce Resource in the Jordan River Basin. (Cambridge Middle East Library)
- Worster, Donald (1992). Rivers of Empire: Water, Aridity, and the Growth of the American West.
- Reisner, Marc (1993). Cadillac Desert: The American West and Its Disappearing Water.
- Maude Barlow, Tony Clarke (2003). Blue Gold: The Fight to Stop the Corporate Theft of the World's Water.
- Vandana Shiva (2002). Water Wars: Privatization, Pollution, and Profit. London: Pluto Press [u.a.]. OCLC 231955339. ISBN 0-7453-1837-1.
- Anita Roddick, et al (2004). Troubled Water: Saints, Sinners, Truth And Lies About The Global Water Crisis.
- William E. Marks (2001). The Holy Order of Water: Healing Earths Waters and Ourselves.
Enlaces externos
Wikilibros
[Categoría:Explotación de los recursos naturales]]




![L_{bigodot} approx 3.827 cdot 10^{26} [W]](https://petalofucsia.blogia.com/upload/externo-f711cf48887d5489e00da25c781bde8a.png) .
. ![P_{bigodot} = 1367 left [ frac {W} {m^2}right ]](https://petalofucsia.blogia.com/upload/externo-25e85f2ae6fdbfc78acba6897955e92e.png) .
. ![S_E = 4 pi {R^2} [ m^2 ] approx 4 cdot 3,1415 cdot (1,496 cdot 10^{11} )^2 {[m^2]}](https://petalofucsia.blogia.com/upload/externo-32cec68ba73029bdcdab584391e5af7c.png) .
. ![S_E approx 2,812 cdot 10^{23} {[m^2]}](https://petalofucsia.blogia.com/upload/externo-9e5b1d335d9740b93e471112f4cf1ad9.png) .
. ![L_{bigodot} = P_{bigodot} cdot S_E left [ W right ]](https://petalofucsia.blogia.com/upload/externo-2b1932d36d1c02b9deefebb2c8309946.png) .
. ![L_{bigodot} approx 1367 left [ frac {W} {m^2}right ] cdot 2,812 cdot 10^{23} {[m^2]}](https://petalofucsia.blogia.com/upload/externo-1f0c37eeecff262acd338f4cc23dbd79.png) .
. ![L_{bigodot} approx 3.8 cdot 10^{26} [W]](https://petalofucsia.blogia.com/upload/externo-b9537295fbc33b0742b6543839274623.png) .
. 
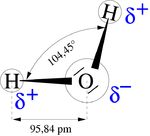
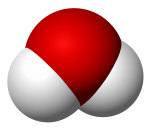








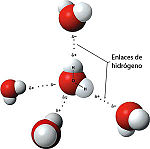

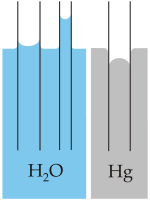





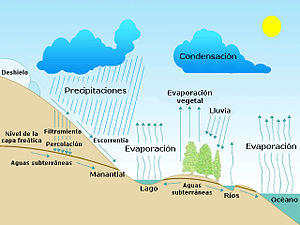











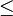 17 mg/l
17 mg/l 




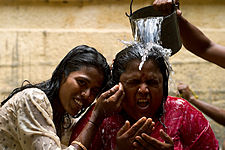





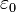 ) en unidades del
) en unidades del 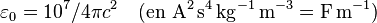
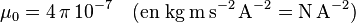 .
. 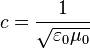
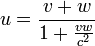
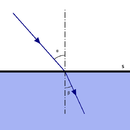
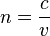
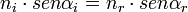







 .
.
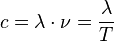

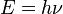
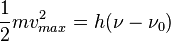
 ) entre un
) entre un