CIENCIA3: COMPRENDEMOS QUE OCUPAMOS ESPACIO A LO HONDO PORQUE PESAMOS Y A LO ANCHO PORQUE HAY GASES Y LOS GASES SE EXPANDEN, UNA SUSTANCIA SIN PESO PUEDE SER MUY PEQUEÑA O INFINITAMENTE PEQUEÑA Y NO OCUPAR ESPACIO, NO OCUPAR NADA SI NO PESA NADA, ¿CUÁL ES SU OPINIÓN? AL PRINCIPIO ERA HABÍA BASTANTE ESPACIO HACIA ARRIBA PERO NO SE AVANZABA MUCHO Y HACIA LOS LATERALES NO. Se denomina gas al estado de agregación de la materia que no tiene forma ni volumen propio. Su principal composición son moléculas no unidas, expandidas y con poca fuerza de atracción, haciendo que no tengan volumen y forma definida, provocando que este se expanda para ocupar todo el volumen del recipiente que la contiene, con respecto a los gases, las fuerzas gravitatorias y de atracción entre partículas, resultan insignificantes.
Gas
Se denomina gas al estado de agregación de la materia que no tiene forma ni volumen propio. Su principal composición son moléculas no unidas, expandidas y con poca fuerza de atracción, haciendo que no tengan volumen y forma definida, provocando que este se expanda para ocupar todo el volumen del recipiente que la contiene, con respecto a los gases, las fuerzas gravitatorias y de atracción entre partículas, resultan insignificantes.
Existen diversas leyes que relacionan la presión, el volumen y la temperatura de un gas.
Contenido[ocultar] |
[editar] Ley de Avogadro
Es aquella en el que las constantes son presión y temperatura, siendo el Volumen directamente proporcional al Número de moles (n)
matemáticamente, la fórmula es:
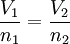
[editar] Ley de Charles
A una presión dada, el volumen ocupado por un gas es directamente proporcional a su temperatura.
Matemáticamente la expresión:
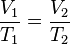 o
o 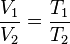
[editar] Ley de Gay-Lussac
La presión del gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura:
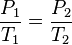
Es por esto que para poder envasar gas, como gas licuado, primero se ha de enfriar el volumen de gas deseado, hasta una temperatura característica de cada gas, a fin de poder someterlo a la presión requerida para licuarlo sin que se sobrecaliente, y, eventualmente, explote.
[editar] Ley de los gases ideales
Las tres leyes mencionadas pueden combinarse matemáticamente en la llamada ley general de los gases. Su expresión matemática es:
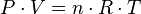
siendo P la presión, V el volumen, n el número de moles, R la constante universal de los gases ideales y T la temperatura en Kelvin.
El valor de R depende de las unidades que se estén utilizando:
- R = 0,082 atm·l·K−1·mol−1 si se trabaja con atmósferas y litros
- R = 8,31451 J·K−1·mol−1 si se trabaja en Sistema Internacional de Unidades
- R = 1,987 cal·K−1·mol−1
- R = 8,31451 10−10 erg ·K−1·mol−1
De esta ley se deduce que un mol de gas ideal ocupa siempre un volumen igual a 22,4 litros a 0 °C y 1 atmósfera. También se le llama la ecuación de estado de los gases; ya que solo depende del estado actual en que se encuentre el gas.
[editar] Gases finales
Si se quiere afinar más o si se quiere medir el comportamiento de algún gas que escapa al comportamiento ideal habrá que recurrir a las ecuaciones de los gases reales que son variadas y más complicadas cuanto más precisas.
Los gases reales no se expanden infinitamente, sino que llegaría un momento en el que no ocuparían más volumen. Esto se debe a que entre sus átomos/moléculas se establecen unas fuerzas bastante pequeñas, debido a los cambios aleatorios de sus cargas electrostáticas, a las que se llama fuerzas de Van der Waals.
El comportamiento de un gas suele concordar más con el comportamiento ideal cuanto más sencilla sea su fórmula química y cuanto menor sea su reactividad, tendencia a formar enlaces. Así, por ejemplo, los gases nobles al ser monoatómicos y tener muy baja reactividad, sobre todo el helio, tendrán un comportamiento bastante cercano al ideal. Les seguirán los gases diatómicos, en particular el más liviano hidrógeno. Menos ideales serán los triatómicos como el dióxido de carbono, el caso del vapor de agua aún es peor ya que la molécula al ser polar tiende a establecer puentes de hidrógeno lo que aún reduce más la idealidad. Dentro de los gases orgánicos el que tendrá un comportamiento más ideal será el metano perdiendo idealidad a medida que se engrosa la cadena de carbono. Así el butano es de esperar que tenga un comportamiento ya bastante alejado de la idealidad. Esto es porque cuanto más grande es la partícula fundamental constituyente del gas, mayor es la probabilidad de colisión e interacción entre ellas, factor que hace disminuir la idealidad. Algunos de estos gases se pueden aproximar bastante bien mediante las ecuaciones ideales mientras que en otros casos hará falta recurrir a ecuaciones reales muchas veces deducidas empíricamente a partir del ajuste de parámetros.
También se pierde la idealidad en condiciones extremas, altas presiones o bajas temperaturas. Por otra parte, la concordancia con la idealidad puede aumentar si trabajamos a bajas presiones o altas temperaturas. También por su estabilidad química.
[editar] Comportamiento de los gases
Para el comportamiento térmico de partículas de la materia existen cuatro cantidades medibles que son de gran interés: presión, volumen, temperatura y masa de la muestra del material.
Cualquier gas se considera como un fluido, porque tiene las propiedades que le permiten comportarse como tal.
Sus moléculas, en continuo movimiento, logran colisionar las paredes que los contiene y casi todo el tiempo ejercen una presión permanente. Como el gas se expande, la energía intermolecular (entre molécula y molécula) hace que un gas, al ir añadiéndole energía calorífica, tienda a aumentar su volumen.
Un gas tiende a ser activo químicamente debido a que su superficie molecular es también grande, es decir entre cada partícula se realiza mayor contacto, haciendo más fácil una o varias reacciones entre las sustancias.
Para entender mejor el comportamiento de un gas siempre se realizan estudios con respecto al gas ideal aunque este en realidad nunca existe y las propiedades de este son:
- Un gas está constituido por moléculas de igual tamaño y masa, pero una mezcla de gases diferentes, no.
- Se le supone con un número pequeño de moléculas, así su densidad es baja y su atracción molecular es nula.
- El volumen que ocupa el gas es mínimo, en comparación con el volumen total del recipiente.
- Las moléculas de un gas contenidas en un recipiente, se encuentran en constante movimiento, por lo que chocan, ya entre sí o contra las paredes del recipiente que las contiene.
Para explicar el comportamiento de los gases, las nuevas teorías utilizan tanto la estadística como la teoría cuántica, además de experimentar con gases de diferentes propiedades o propiedades límite, como el UF6, que es el gas más pesado conocido.
Un gas no tiene forma ni volumen fijo; se caracteriza por la casi nula cohesión y a la gran energía cinética de sus moléculas, las cuales se mueven.
[editar] Véase también
- Amedeo Avogadro
- Número de Avogadro
- Presión parcial
- Gas combustible
- Gas noble
- Estado de agregación de la materia
- Cambio de estado
- Gases medicinales
[editar] Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Gases. Commons
Wikimedia Commons alberga contenido multimedia sobre Gases. Commons Wikcionario tiene definiciones para gas.Wikcionario
Wikcionario tiene definiciones para gas.Wikcionario

3 comentarios
petalofucsia -
petalofucsia -
liviano, na
1.adj. De poco peso, ligero:
tejido liviano.
2.Leve, de poca importancia:
comedia liviana.
3.Fácil:
trabajo liviano.
Preguntas en los foros con la(s) palabra(s) 'liviano' en el título:
Ningún título tiene la(s) palabra(s) 'liviano'.Pregunta tú mismo.
Visita el foro.
'liviano' también aparece en estas entradas
-ano - ingrávido - liviandad - ultraligero
-----
Diccionario de sinónimos y antónimos © 2005 Espasa-Calpe:
liviano
ligero, leve, tenue, menudo, etéreo, vaporoso, sutil, frágil
◦Antónimos: pesado, firme
libertino, lujurioso, inmoral, desvergonzado
frívolo, superficial, ligero, inconstante, voluble
◦Antónimos: serio, constante
'liviano' también aparece en estas entradas
ágil - veraniego - leve - ligero - malo - superficial
------
liviano, na.
(Del lat. vulg. *leviānus, de levis).
1. adj. De poco peso.
2. adj. inconstante (‖ que muda con facilidad de pensamientos).
3. adj. De poca importancia.
4. adj. Dicho de una mujer: Informal y ligera en su relación con los hombres.
5. adj. p. us. Lascivo, incontinente.
6. m. Pulmón, principalmente el de las reses destinadas al consumo. U. m. en pl.
7. m. Burro que va delante y sirve de guía a la recua.
8. f. Canto popular andaluz.
Real Academia Española © Todos los derechos reservados
petalofucsia -
Diccionario de la lengua española © 2005 Espasa-Calpe:
etéreo, a
1.adj. quím. Del éter o relativo a él:
sustancia etérea.
2.No concreto, poco determinado, vago:
nos dio una respuesta etérea.
3.poét. Del cielo o perteneciente a él:
color etéreo.
----
Diccionario de sinónimos y antónimos © 2005 Espasa-Calpe:
etéreo
sutil, volátil, impalpable, sublime, irreal, abstracto, puro, elevado
'etereo' también aparece en estas entradas
atmosférico - divino - gaseoso - grácil - incorpóreo - ingrávido - intangible - invisible - ligero - liviano - seráfico - vaporoso - volátil
-----
etéreo, a.
1. adj. Perteneciente o relativo al éter.
2. adj. poét. Perteneciente o relativo al cielo.
3. adj. poét. Vago, sutil, vaporoso.
Real Academia Española © Todos los derechos reservados