MEDICINA: ÁTOMOS. En química y física, átomo (del latín atomum, y éste del griego ἄτομον, sin partes)[1] es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
Átomo
De Wikipedia, la enciclopedia libre

En química y física, átomo (del latín atomum, y éste del griego ἄτομον, sin partes)[1] es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
El concepto de átomo como bloque básico e indivisible que compone la materia del universo fue postulado por la escuela atomista en la Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el siglo XIX. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas.[2] [3]
Contenido[ocultar] |
Estructura atómica
La teoría aceptada hoy es que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleones, alrededor del cual se encuentra una nube de electrones de carga negativa.
El núcleo atómico
El núcleo del átomo se encuentra formado por nucleones, los cuales pueden ser de dos clases:
- Protones: Partícula de carga eléctrica positiva igual a una carga elemental, y 1,67262 × 10–27 kg y una masa 1837 veces mayor que la del electrón.
- Neutrones: Partículas carentes de carga eléctrica y una masa un poco mayor que la del protón (1,67493 × 10–27 kg).
El núcleo más sencillo es el del hidrógeno, formado únicamente por un protón. El núcleo del siguiente elemento en la tabla periódica, el helio, se encuentra formado por dos protones y dos neutrones. La cantidad de protones contenidas en el núcleo del átomo se conoce como número atómico, el cual se representa por la letra Z y se escribe en la parte inferior izquierda del símbolo químico. Es el que distingue a un elemento químico de otro. Según lo descrito anteriormente, el número atómico del hidrógeno es 1 (1H), y el del helio, 2 (2He).
La cantidad total de nucleones que contiene un átomo se conoce como número másico, representado por la letra A y escrito en la parte superior izquierda del símbolo químico. Para los ejemplos dados anteriormente, el número másico del hidrógeno es 1(1H), y el del helio, 4(4He).
Existen también átomos que tienen el mismo número atómico, pero diferente número másico, los cuales se conocen como isótopos. Por ejemplo, existen tres isótopos naturales del hidrógeno, el protio (1H), el deuterio (2H) y el tritio (3H). Todos poseen las mismas propiedades químicas del hidrógeno, y pueden ser diferenciados únicamente por ciertas propiedades físicas.
Otros términos menos utilizados relacionados con la estructura nuclear son los isótonos, que son átomos con el mismo número de neutrones. Los isóbaros son átomos que tienen el mismo número másico.
Debido a que los protones tienen cargas positivas se deberían repeler entre sí, sin embargo, el núcleo del átomo mantiene su cohesión debido a la existencia de otra fuerza de mayor magnitud, aunque de menor alcance conocida como la interacción nuclear fuerte.
Interacciones eléctricas entre protones y electrones
Antes del experimento de Rutherford la comunidad científica aceptaba el modelo atómico de Thomson, situación que varió después de la experiencia de Rutherford. Los modelos posteriores se basan en una estructura de los átomos con una masa central cargada positívamente rodeada de una nube de carga negativa.[4]
Este tipo de estructura del átomo llevó a Rutherford a proponer su modelo en que los electrones se moverían alrededor del núcleo en órbitas. Este modelo tiene una dificultad proveniente del hecho de que una partícula cargada acelerada, como sería necesario para mantenerse en órbita, radiaría radiación electromagnética, perdiendo energía. Las leyes de Newton, junto con la ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10−10 s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.[5]
Nube electrónica
Alrededor del núcleo se encuentran los electrones que son partículas elementales de carga negativa igual a una carga elemental y con una masa de 9,10 × 10–31 kg
La cantidad de electrones de un átomo en su estado basal es igual a la cantidad de protones que contiene en el núcleo, es decir, al número atómico, por lo que un átomo en estas condiciones tiene una carga eléctrica neta igual a 0.
A diferencia de los nucleones, un átomo puede perder o adquirir algunos de sus electrones sin modificar su identidad química, transformándose en un ion, una partícula con carga neta diferente de cero.
El concepto de que los electrones se encuentran en órbitas satelitales alrededor del núcleo se ha abandonado en favor de la concepción de una nube de electrones deslocalizados o difusos en el espacio, el cual representa mejor el comportamiento de los electrones descrito por la mecánica cuántica únicamente como funciones de densidad de probabilidad de encontrar un electrón en una región finita de espacio alrededor del núcleo.
Dimensiones atómicas
La mayor parte de la masa de un átomo se concentra en el núcleo, formado por los protones y los neutrones, ambos conocidos como nucleones, los cuales son 1836 y 1838 veces más pesados que el electrón respectivamente.
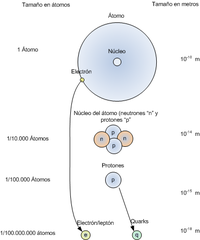
El tamaño o volumen exacto de un átomo es difícil de calcular, ya que las nubes de electrones no cuentan con bordes definidos, pero puede estimarse razonablemente en 1,0586 × 10–10 m, el doble del radio de Bohr para el átomo de hidrógeno. Si esto se compara con el tamaño de un protón, que es la única partícula que compone el núcleo del hidrógeno, que es aproximadamente 1 × 10–15 se ve que el núcleo de un átomo es cerca de 100.000 veces menor que el átomo mismo, y sin embargo, concentra prácticamente el 100% de su masa.
Para efectos de comparación, si un átomo tuviese el tamaño de un estadio, el núcleo sería del tamaño de una canica colocada en el centro, y los electrones, como partículas de polvo agitadas por el viento alrededor de los asientos.
Historia de la teoría atómica
El concepto de átomo existe desde la Antigua Grecia propuesto por los filósofos griegos Demócrito, Leucipo y Epicuro, sin embargo, no se generó el concepto por medio de la experimentación sino como una necesidad filosófica que explicara la realidad, ya que, como proponían estos pensadores, la materia no podía dividirse indefinidamente, por lo que debía existir una unidad o bloque indivisible e indestructible que al combinarse de diferentes formas creara todos los cuerpos macroscópicos que nos rodean.[6] El siguiente avance significativo se realizó hasta en 1773 el químico francés Antoine-Laurent de Lavoisier postuló su enunciado: "La materia no se crea ni se destruye, simplemente se transforma."; demostrado más tarde por los experimentos del químico inglés John Dalton quien en 1804, luego de medir la masa de los reactivos y productos de una reacción, y concluyó que las sustancias están compuestas de átomos esféricos idénticos para cada elemento, pero diferentes de un elemento a otro.[7]
Luego en 1811 Amedeo Avogadro, físico italiano, postuló que a una temperatura, presión y volumen dados, un gas contiene siempre el mismo número de partículas, sean átomos o moléculas, independientemente de la naturaleza del gas, haciendo al mismo tiempo la hipótesis de que los gases son moléculas poliatómicas con lo que se comenzó a distinguir entre átomos y moléculas.[8]
El químico ruso Dmítri Ivánovich Mendeléyev creó en 1869 una clasificación de los elementos químicos en orden creciente de su masa atómica, remarcando que existía una periodicidad en las propiedades químicas. Este trabajo fue el precursor de la tabla periódica de los elementos como la conocemos actualmente.[9]
La visión moderna de su estructura interna tuvo que esperar hasta el experimento de Rutherford en 1911 y el modelo atómico de Bohr. Posteriores descubrimientos científicos, como la teoría cuántica, y avances tecnológicos, como el microscopio electrónico, han permitido conocer con mayor detalle las propiedades físicas y químicas de los átomos.[10]
Evolución del modelo atómico
La concepción del átomo que se ha tenido a lo largo de la historia ha variado de acuerdo a los descubrimientos realizados en el campo de la física y la química. A continuación se hará una exposición de los modelos atómicos propuestos por los científicos de diferentes épocas. Algunos de ellos son completamente obsoletos para explicar los fenómenos observados actualmente, pero se incluyen a manera de reseña histórica.
Modelo de Dalton
Fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton, quien imaginaba a los átomos como diminutas esferas.[11] Este primer modelo atómico postulaba:
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
- Los átomos permanecen sin división, aun cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos, la radioactividad ni la presencia de los electrones (e-) o protones(p+).
Modelo de Thomson
Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo inmersos en una masa de carga positiva a manera de pasas en un pastel (de la analogía del inglés plum-pudding model) o uvas en gelatina. Posteriormente Jean Perrin propuso un modelo modificado a partir del de Thompson donde las "pasas" (electrones) se situaban en la parte exterior del "pastel" (la carga positiva).
Detalles del modelo atómico
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas. Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva. En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones.
Modelo de Rutherford
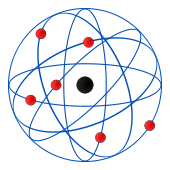
Este modelo fue desarrollado por el físico Ernest Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911. Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa, sin embargo, a diferencia del anterior, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas con un espacio vacío entre ellos. A pesar de ser un modelo obsoleto, es la percepción más común del átomo del público no científico.
Rutherford predijo la existencia del neutrón en el año 1920, por esa razón en el modelo anterior (Thomson), no se habla de éste.
Por desgracia, el modelo atómico de Rutherford presentaba varias incongruencias:
- Contradecía las leyes del electromagnetismo de James Clerk Maxwell, las cuales estaban muy comprobadas mediante datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (en este caso el electrón) debería emitir energía constantemente en forma de radiación y llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría. Todo ocurriría muy brevemente.
- No explicaba los espectros atómicos.
Modelo de Bohr
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford, Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
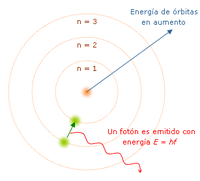
“El átomo es un pequeño sistema solar con un núcleo en el centro y electrones moviéndose alrededor del núcleo en órbitas bien definidas.” Las órbitas están cuantizadas (los e- pueden estar solo en ciertas órbitas)
- Cada órbita tiene una energía asociada. La más externa es la de mayor energía.
- Los electrones no radian energía (luz) mientras permanezcan en órbitas estables.
- Los electrones pueden saltar de una a otra órbita. Si lo hace desde una de menor energía a una de mayor energía absorbe un cuanto de energía (una cantidad) igual a la diferencia de energía asociada a cada órbita. Si pasa de una de mayor a una de menor, pierde energía en forma de radiación (luz).
El mayor éxito de Bohr fue dar la explicación al espectro de emisión del hidrógeno. Pero solo la luz de este elemento. Proporciona una base para el carácter cuántico de la luz, el fotón es emitido cuando un electrón cae de una órbita a otra, siendo un pulso de energía radiada.
Bohr no puede explicar la existencia de órbitas estables y para la condición de cuantización.
Bohr encontró que el momento angular del electrón es h/2π por un método que no puede justificar.
Modelo de Schrödinger: modelo actual
Después de que Louis-Victor de Broglie propuso la naturaleza ondulatoria de la materia en 1924, la cual fue generalizada por Erwin Schrödinger en 1926, se actualizó nuevamente el modelo del átomo.
En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La gráfica siguiente muestra los orbitales para los primeros niveles de energía disponibles en el átomo de hidrógeno.
Referencias
- ↑ «Átomo», en Diccionario de la Lengua Española (22ª ed.). Real Academia Española (2001). Consultado el 20 de julio de 2009.
- ↑ Haubold, Hans; Mathai, A. M. (1998). «Microcosmos: From Leucippus to Yukawa». Structure of the Universe. Common Sense Science. Consultado el 17-01-2008.
- ↑ Harrison (2003:123–139).
- ↑ Antonio Rañada(1990), Dinámica Clásica. Madrid, Alianza Editorial, S. A. 84-206-8133-4
- ↑ B.H. Bransden and C.J. Joachain (1992), Physics of Atomos and Molecules. Harlow-Essex-England, Longman Group Limited. 0-582-44401-2
- ↑ presocraticos/Atomistas/atomis.html Filósofos Presocráticos: Atomistas, Leucipo y Demócrito
- ↑ Protagonistas de la revolución:Lavoisier, A.L.
- ↑ Amedeo Avogadro (en italiano)
- ↑ Elements and Atoms: Chapter 12: Mendeleev's First Periodic Table (en inglés)
- ↑ Experimento de Rutherford
- ↑ Rincón Arce, Alvaro (1983) ABC de Química Primer Curso, Editorial Herrero, México, ISBN: 968-420-294-6.
- Cronología del modelo atómico (en inglés).
- Sokolovsky, Silvia (2002). «El Átomo»..
- Bricks of the Universe: the Building Blocks of Matter (material divulgativo del CERN).
Véase también
- Molécula
- Tabla periódica de los elementos
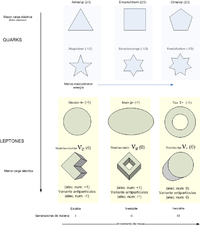
- Modelo estándar de física de partículas
- Fisión y fusión nuclear
- Acelerador de partículas
- Medicina nuclear
- Arma nuclear
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Átomo.Commons
Wikimedia Commons alberga contenido multimedia sobre Átomo.Commons - Energía nuclear: el poder del átomo





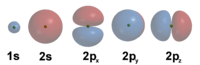


0 comentarios