ENERGÍA, MAQUINARIA Y MOTORES: PROPIEDADES FÍSICAS Y QUÍMICAS DEL AGUA. El agua es una sustancia que químicamente se formula como H2O; es decir, que una molécula de agua se compone de dos átomos de hidrógeno enlazados covalentemente a un átomo de oxígeno.
Propiedades físicas y químicas

El agua es una sustancia que químicamente se formula como H2O; es decir, que una molécula de agua se compone de dos átomos de hidrógeno enlazados covalentemente a un átomo de oxígeno.
Fue Henry Cavendish quien descubrió en 1781 que el agua es una sustancia compuesta y no un elemento, como se pensaba desde la Antigüedad. Los resultados de dicho descubrimiento fueron desarrollados por Antoine Laurent de Lavoisier dando a conocer que el agua estaba formada por oxígeno e hidrógeno. En 1804, el químico francés Joseph Louis Gay-Lussac y el naturalista y geógrafo alemán Alexander von Humboldt demostraron que el agua estaba formada por dos volúmenes de hidrógeno por cada volumen de oxígeno (H2O).
Las propiedades fisicoquímicas más notables del agua son:
- El agua es insípida e inodora en condiciones normales de presión y temperatura. El color del agua varía según su estado: como líquido, puede parecer incolora en pequeñas cantidades, aunque en el espectrógrafo se prueba que tiene un ligero tono azul verdoso. El hielo también tiende al azul y en estado gaseoso (vapor de agua) es incolora.[11]
- El agua bloquea sólo ligeramente la radiación solar UV fuerte, permitiendo que las plantas acuáticas absorban su energía.
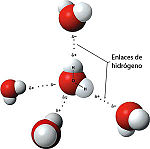
- Ya que el oxígeno tiene una electronegatividad superior a la del hidrógeno, el agua es una molécula polar. El oxígeno tiene una ligera carga negativa, mientras que los átomos de hidrógenos tienen una carga ligeramente positiva del que resulta un fuerte momento dipolar eléctrico. La interacción entre los diferentes dipolos eléctricos de una molécula causa una atracción en red que explica el elevado índice de tensión superficial del agua.
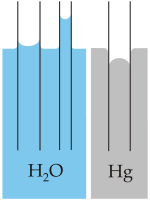
- La fuerza de interacción de la tensión superficial del agua es la fuerza de van der Waals entre moléculas de agua. La aparente elasticidad causada por la tensión superficial explica la formación de ondas capilares. A presión constante, el índice de tensión superficial del agua disminuye al aumentar su temperatura.[12] También tiene un alto valor adhesivo gracias a su naturaleza polar.
- La capilaridad se refiere a la tendencia del agua de moverse por un tubo estrecho en contra de la fuerza de la gravedad. Esta propiedad es aprovechada por todas las plantas vasculares, como los árboles.
- Otra fuerza muy importante que refuerza la unión entre moléculas de agua es el enlace por puente de hidrógeno.[13]
- El punto de ebullición del agua (y de cualquier otro líquido) está directamente relacionado con la presión atmosférica. Por ejemplo, en la cima del Everest, el agua hierve a unos 68º C, mientras que al nivel del mar este valor sube hasta 100º. Del mismo modo, el agua cercana a fuentes geotérmicas puede alcanzar temperaturas de cientos de grados centígrados y seguir siendo líquida.[14] Su temperatura crítica es de 373.85 °C (647,14º K), su valor específico de fusión es de 0,334 kJ/g y su índice específico de vaporización es de 2,23kJ/g.[15]
- El agua es un disolvente muy potente, al que se ha catalogado como el disolvente universal, y afecta a muchos tipos de sustancias distintas. Las sustancias que se mezclan y se disuelven bien en agua -como las sales, azúcares, ácidos, álcalis, y algunos gases (como el oxígeno o el dióxido de carbono, mediante carbonación)- son llamadas hidrófilas, mientras que las que no combinan bien con el agua -como lípidos y grasas- se denominan sustancias hidrofóbicas. Todos los componentes principales de las células de proteínas, ADN y polisacáridos se disuelven en agua. Puede formar un azeótropo con muchos otros disolventes.
- El agua es miscible con muchos líquidos, como el etanol, y en cualquier proporción, formando un líquido homogéneo. Por otra parte, los aceites son inmiscibles con el agua, y forman capas de variable densidad sobre la superficie del agua. Como cualquier gas, el vapor de agua es miscible completamente con el aire.
- El agua pura tiene una conductividad eléctrica relativamente baja, pero ese valor se incrementa significativamente con la disolución de una pequeña cantidad de material iónico, como el cloruro de sodio.
- El agua tiene el segundo índice más alto de capacidad calorífica específica -sólo por detrás del amoníaco- así como una elevada entalpía de vaporización (40.65 kJ mol-1); ambos factores se deben al enlace de hidrógeno entre moléculas. Estas dos inusuales propiedades son las que hacen que el agua "modere" las temperaturas terrestres, reconduciendo grandes variaciones de energía.
- La densidad del agua líquida es muy estable y varía poco con los cambios de temperatura y presión. A la presión normal (1 atmósfera), el agua líquida tiene una mínima densidad (0,958 kg/l) a los 100 °C. Al bajar la temperatura, aumenta la densidad (por ejemplo, a 90 °C tiene 0,965 kg/l) y ese aumento es constante hasta llegar a los 3,8 °C donde alcanza una densidad de 1 kg/litro. Esa temperatura (3,8 °C) representa un punto de inflexión y es cuando alcanza su máxima densidad (a la presión mencionada). A partir de ese punto, al bajar la temperatura, la densidad comienza a disminuir, aunque muy lentamente (casi nada en la práctica), hasta que a los 0° disminuye hasta 0,9999 kg/litro. Cuando pasa al estado sólido (a 0 °C), ocurre una brusca disminución de la densidad pasando de 0,9999 kg/l a 0,917 kg/l.
- El agua puede descomponerse en partículas de hidrógeno y oxígeno mediante electrólisis.
- Como un óxido de hidrógeno, el agua se forma cuando el hidrógeno -o un compuesto conteniendo hidrógeno- se quema o reacciona con oxígeno -o un compuesto de oxígeno-. El agua no es combustible, puesto que es un producto residual de la combustión del hidrógeno. La energía requerida para separar el agua en sus dos componentes mediante electrólisis es superior a la energía desprendida por la recombinación de hidrógeno y oxígeno. Esto hace que el agua, en contra de lo que sostienen algunos rumores,[16] no sea una fuente de energía eficaz.[17]
- Los elementos que tienen mayor electropositividad que el hidrógeno -como el litio, el sodio, el calcio, el potasio y el cesio- desplazan el hidrógeno del agua, formando hidróxidos. Dada su naturaleza de gas inflamable, el hidrógeno liberado es peligroso y la reacción del agua combinada con los más electropositivos de estos elementos es una violenta explosión.
Actualmente se sigue investigando sobre la naturaleza de este compuesto y sus propiedades, a veces traspasando los límites de la ciencia convencional.[18] En este sentido, el investigador John Emsley, divulgador científico, dijo en cierta ocasión del agua que "(Es) una de las sustancias químicas más investigadas, pero sigue siendo la menos entendida".[19]
Obtenido de http://es.wikipedia.org/wiki/Agua#Propiedades_f.C3.ADsicas_y_qu.C3.ADmicas

0 comentarios